题目内容
【题目】某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式。如果将它们按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“●”代表一种元素,其中A代表氢元素。
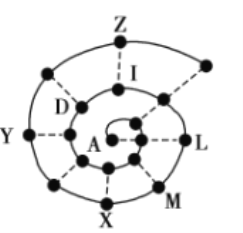
(1)X的元素符号为______,I元素在周期表中的位置为______。
(2)M与Z两种元素形成的化合物的化学式为______。
(3)下列说法正确的是______(填序号)。
a.I元素形成的单质通入LZ的溶液中可得Z元素形成的单质
b.虚线相连的元素处于同一主族
c.L元素形成的单质在D元素形成的单质中燃烧生成![]()
d.X、Y、M元素为同周期元素
【答案】Al 第二周期ⅦA族 MgCl2 d
【解析】
A点代表H,按照原子序数由小到大由里往外延伸,由图可知,D为O、I为F、L为Na、M为Mg、X为Al、Y为P,Z为Cl,虚线连接的原子处于同主族,据以上分析解答。
(1)X的原子序数为13,为![]() 元素;
元素;![]() 的原子序数为9,为F元素,在元素周期表的第二周期ⅦA族;
的原子序数为9,为F元素,在元素周期表的第二周期ⅦA族;
(2)M是![]() 元素、Z是
元素、Z是![]() 元素,二者形成离子化合物
元素,二者形成离子化合物![]() ;
;
(3)a.L是Na元素,![]() 与
与![]() 溶液反应时,
溶液反应时,![]() 直接与H2O直接反应,不能得到
直接与H2O直接反应,不能得到![]() ,a项错误;
,a项错误;
b.虚线相连的元素处于同一族,图中包含主族和0族元素,不全部是主族元素,b项错误;
c.D是![]() 元素,
元素,![]() 在
在![]() 中燃烧生成
中燃烧生成![]() ,不是
,不是![]() ,c项错误;
,c项错误;
d.Y是![]() 元素,
元素,![]() 、
、![]() 、
、![]() 都是第三周期元素,d项正确;
都是第三周期元素,d项正确;
故答案选d。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目