题目内容
【题目】高纯二氧化碳主要用于医学研究及临床诊断及电子工业;含碳的有机物醇、醛在生产生活中有广泛运用。
I.(1)工业上用CO2和H2在一定条件下反应可合成二甲醚,已知:
2CO2(g)+6H2(g)=2CH3OH(g)+2H2O(g) △H1=-107.4kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2=-23.4kJ/mol
则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=________kJ/mol
CH3OCH3(g)+3H2O(g) △H3=________kJ/mol
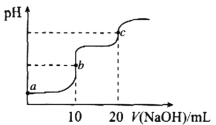
(2)在一定条件下将CO2和H2充入一固定容积的密闭容器中,在两种不同温度下发生反应:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g),测得CH3OCH3(g)的物质的量随时间的变化如图所示。
CH3OCH3(g)+3H2O(g),测得CH3OCH3(g)的物质的量随时间的变化如图所示。
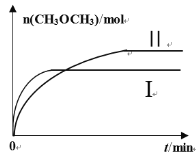
①曲线I、Ⅱ对应的平衡常数大小关系为KI_______KⅡ(填“>”“=”或“<”)。
②一定温度下,下列能判断该反应达到化学平衡状态的是________(填序号)。
a.混合气体密度不变
b.二甲醚和水蒸气的反应速率之比保持不变
c.v正(H2)=2v逆(H2O)
d.2个C=O断裂的同时有3个H-O断裂
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g)+2H2(g)![]() CH3OH(g) △H。在某压强下,合成甲醇的反应在不同温度、不同投料比时,CO的转化率如图所示。
CH3OH(g) △H。在某压强下,合成甲醇的反应在不同温度、不同投料比时,CO的转化率如图所示。
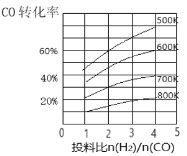
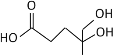
①600K温度下,将1molCO和4molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(H2)=___________。
②若投料比保持不变,升高温度,该反应平衡向_______方向移动(填“正反应”或“逆反应”)。
③上述合成甲醇的过程中提高CO的转化率可采取的措施有______。(列举一种即可)。
Ⅱ.用隔膜电解法处理高浓度乙醛废水的原理为:
使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,总反应为:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程。
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程。
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极产生气体的电极反应为:______。
②在实际工艺处理过程中,阴极区乙醛的去除率可达80%。若在两极区分别注入1m3乙醛含量为400mg/L的废水,可得到乙醇________kg(计算结果保留2位小数)。
【答案】-130.8 < cd 0.12mol/(L·min) 逆反应 增大压强、降低温度、分离出甲醇、增大氢气的浓度等 2H2O-4e-=O2+4H+或4OH--4e-=O2+2H2O 0.33
【解析】
I.(1)2CO2(g)+6H2(g)=2CH3OH(g)+2H2O(g) △H1=-107.4kJ/mol ①
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2=-23.4kJ/mol ②
利用盖斯定律,将①+②得:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=(-107.4)+(-23.4)kJ/mol=-130.8 kJ/mol。答案为:-130.8;
CH3OCH3(g)+3H2O(g) △H3=(-107.4)+(-23.4)kJ/mol=-130.8 kJ/mol。答案为:-130.8;
(2)①从曲线中可以看出,曲线I先达平衡,则曲线I的温度高,此时n(CH3OCH3)小,则升高温度平衡逆向移动,正反应为放热反应,所以曲线I、Ⅱ对应的平衡常数大小关系为KI<KⅡ。
②a.因为混合气体的体积不变、质量不变,所以混合气体密度始终不变,密度不变时不一定达平衡状态,a不符合题意;
b.二甲醚和水蒸气都是生成物,二者的反应速率之比始终等于化学计量数之比,速率之比保持不变时,不一定达平衡状态,b不符合题意;
c.v正(H2)=2v逆(H2O)时,反应方向相反,速率之比等于化学计量数之比,反应达平衡状态,c符合题意;
d.2个C=O断裂,同时有3个H-O断裂,则表明若有2个CO2分子参加反应,则同时有3个H2O发生反应,反应的方向相反,则变化量之比等于化学计量数之比,反应达平衡状态,d符合题意;故选cd。答案为:<;cd;
(3)①600K温度下,将1molCO和4molH2充入2L的密闭容器中,此时投料比为4,CO的转化率为60%,参加反应的CO物质的量为0.6mol,则生成H2的物质的量为1.2mol,5min后反应达到平衡状态,则0~5min内的平均反应速率v(H2)=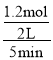 =0.12mol/(L·min)。
=0.12mol/(L·min)。
②若投料比保持不变,升高温度,CO的转化率减小,表明该反应平衡向逆反应方向移动。
③上述合成甲醇的反应,是放热的、体积缩小的可逆反应,所以提高CO的转化率可采取的措施有增大压强、降低温度、分离出甲醇、增大氢气的浓度等。
答案为:0.12mol/(L·min);逆反应;增大压强、降低温度、分离出甲醇、增大氢气的浓度等;
Ⅱ.①电解Na2SO4溶液的实质是电解水,电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极为H2O失电子生成H+和O2,或OH-失电子生成O2和H2O,产生气体的电极反应为:2H2O-4e-=O2+4H+或4OH--4e-=O2+2H2O。
②在阴极区,发生反应为:2H2O+2e-=2OH-+H2↑,CH3CHO+H2→CH3CH2OH,在实际工艺处理过程中,阴极区乙醛的去除率可达80%。若在两极区分别注入1m3乙醛含量为400mg/L的废水,则阴极可得到乙醇的质量为![]() =0.33kg。答案为:2H2O-4e-=O2+4H+或4OH--4e-=O2+2H2O;0.33。
=0.33kg。答案为:2H2O-4e-=O2+4H+或4OH--4e-=O2+2H2O;0.33。

【题目】下列实验的现象和结论都正确的是
实验 | 现象 | 结论 |
A.充分吸收了Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不能燃烧 | Na2SiO3可做防火剂 |
B.测定浓度均为0.1 mol·L-1的CH3COONa与HCOONa溶液的pH | CH3COONa溶液的pH较大 | 结合H+的能力: HCOO->CH3COO- |
C.某溶液中加浓NaOH溶液加热 | 产生能使湿润的蓝色石蕊试纸变红色的气体 | 原溶液中有 |
D.将SO2通入酸性高锰酸钾溶液中 | 溶液褪色 | SO2具有漂白性 |
A.AB.BC.CD.D