题目内容
15.短周期元素X、T、Y、Z、R原子序数依次增大,T最内层电子数为最外层的2倍,部分元素的化合价关系如下表.则下列判断正确的是( )| X | Y | Z | R | |
| 主要化合价 | -4,+4 | -4,+4 | -2,+6 | -1,+7 |
| A. | 非金属性:Z<R<Y | |
| B. | T与R可以形成化合物:TR2 | |
| C. | X与R的单质均能使品红溶液褪色,且褪色原理相同 | |
| D. | T的最高价氧化物的水化物分别能与X、Y、Z的最高价氧化物反应 |
分析 短周期元素X、T、Y、Z、R原子序数依次增大,X、Y的化合价均为-4,+4价,为同一主族,Y的原子序数大于X,则X为C元素、Y为Si元素,Z的化合价为-2,+6,则Z为S元素,R原子序数大于S,则R为Cl元素,T最内层电子数为最外层的2倍,则T为Li或Na,已知T的原子序数大于C元素,则T为Na元素;结合元素周期律与物质的结构性质解答该题.
解答 解:短周期元素X、T、Y、Z、R原子序数依次增大,X、Y的化合价均为-4,+4价,为同一主族,Y的原子序数大于X,则X为C元素、Y为Si元素,Z的化合价为-2,+6,则Z为S元素,R原子序数大于S,则R为Cl元素,T最内层电子数为最外层的2倍,则T为Li或Na,已知T的原子序数大于C元素,则T为Na元素;
A.Z为S元素,R为Cl元素,Y为Si元素,同周期从左到右非金属性逐渐增强,则非金属性:Si<S<Cl,故A错误;
B.T为Na元素,R为Cl元素,T与R可以形成化合物:NaCl,故B错误;
C.X为C元素,R为Cl元素,活性炭具有吸附性能使品红褪色,氯气溶于水生成HClO具有强氧化性,能使品红褪色,二者原理不同,故C错误;
D.T为Na元素,其最高价氧化物的水化物为NaOH,与X、Y、Z的最高价氧化物CO2、SiO2、SO3均能反应,故D正确.
故选D.
点评 本题考查原子结构与位置关系、核外电子排布规律、元素周期律与元素化合物的结构性质等,难度不大,掌握金属性非金属性、最高价氧化物对应水化物的酸性的比较规律.

练习册系列答案
相关题目
3.下列离子反应方程式错误的是( )
| A. | 向Na2SiO3溶液中逐滴加入少量稀盐酸:SiO32-+2H+═H2SiO3(胶体) | |
| B. | 稀Fe(NO3)2溶液中加入稀盐酸:Fe2++4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 将Cu片加入稀硝酸中:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 向NH4Al(SO4)2溶液中加入过量的Ba(OH)2稀溶液:NH4++Al3++2SO42-+2Ba2++5OH-═2BaSO4↓+NH3•H2O+AlO2-+2H2O |
20.NA表示阿伏加德罗常数的值,下列有关说法正确的是( )
| A. | 反应KIO3+6HI=KI+3H2O+3I2,生成3mol I2转移电子的总数为6NA | |
| B. | 标准状况下,由0.4 mol H2O2生成O2转移的电子数目为0.2NA | |
| C. | 12g石墨和C60的混合物中质子总数为6NA | |
| D. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
7.将三种黑色粉末组成的混合物加入到足量的某热浓酸中,充分反应后得到蓝绿色溶液和两种气体,将从蓝绿色溶液中分离得到的盐与0.15mol还原铁粉恰好反应完全,可得浅绿色溶液和6.4g红色沉淀;将上述生成的两种气体通入足量饱和NaHCO3溶液中,仍然收集到两种气体,据此推断黑色粉末可能为( )
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | B. | 物质的量 C:CuO:Fe=3:2:2 | ||
| C. | 质量 MnO2:CuO:C=5.5:8:12 | D. | 质量 Fe:C:CuO=7:5:3 |
4.下列说法正确的是( )
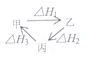

| A. | 甲、乙、丙三物质转化如图所示,则△H1=△H2+△H3 | |
| B. | 1molCO完全燃烧生成稳定氧化物放出热量为283.0KJ,则2 CO2(g)=2 CO(g)+O2(g),△H=+566.0KJ•mol-1 | |
| C. | 若N2(g)+3H2(g)?2NH3(g),△H=-92.4KJ•mol-1,故在某容器中充入1mol N2与3molH2充分反应后,放出的热量为92.4KJ | |
| D. | 常温下,稀HCl和稀NaOH溶液反应生成1molH2O放出热量为57.3 KJ,其热化学方程式为HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(aq),△H=-57.3KJ |
11.常见有机反应类型有:①取代反应 ②加成反应 ③消去反应 ④酯化反应 ⑤加聚反应 ⑥氧化反应 ⑦还原反应,其中可能在有机分子中引入羟基的反应类型是( )
| A. | ①②④ | B. | ⑤⑥⑦ | C. | ①②⑦ | D. | ③④⑤ |
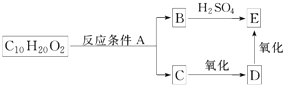
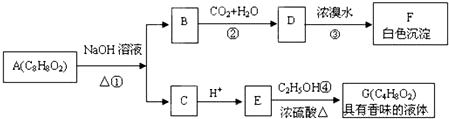
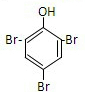 .
.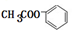 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$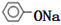 +CH3COONa+H2O.
+CH3COONa+H2O.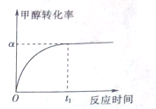 乙酸是重要的有机化工原料,可由乙烯氧化法、甲醛羟基化法等方法生产.回答下列问题:
乙酸是重要的有机化工原料,可由乙烯氧化法、甲醛羟基化法等方法生产.回答下列问题: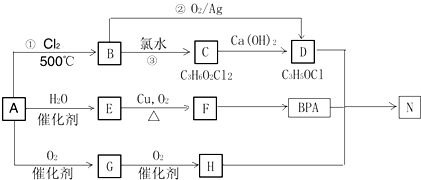
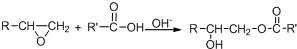
 .
.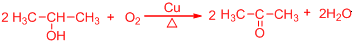 .
.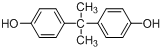 所示,下列说法正确的是ab.
所示,下列说法正确的是ab. .
.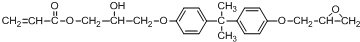
 (其中两种).
(其中两种).