题目内容
【题目】甲醇是未来重要的绿色能源之一。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ、CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.0KJ/mol
Ⅱ、CO(g)+2H2(g)═CH3OH(g) △H=﹣129.0KJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为___。
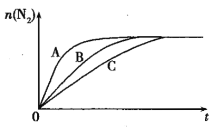
(2)将1.0molCH4和2.0mol H2O(g)通入容积为2L的密闭容器中,在一定条件下发生反应I,测得在一定压强下平衡时CH4的转化率与温度的关系如图1。
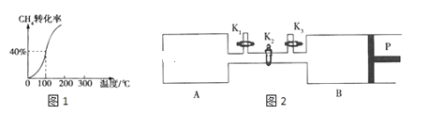
①假设100℃时反应I达到平衡所需的时间为5min,则用H2表示这段时间该反应的平均反应速率为___。
②100℃时反应I的平衡常数为___。若保持温度和容器的容积不变,5min时再向容器中充入H2O(g)和CO各0.2mol,平衡将___移动(填“正向”、“逆向”或“不”)。
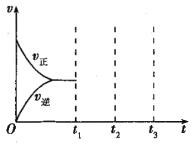
(3)如图2,P是可自由平行滑动的活塞,关闭K2,在相同温度下,通过K1、K3分别向A、B中各充入2mol CO和3molH2,在一定条件下发生反应Ⅱ,关闭K1、K3,反应起始时A、B的体积相同,均为aL。
①反应达到平衡后,A内压强为起始压强的![]() ,则平衡时A容器中H2的体积分数为__。
,则平衡时A容器中H2的体积分数为__。
②若在平衡后打开K2,再次达到平衡后B容器的体积缩至0.6aL,则打开K2之前,B容器的体积为___L。
【答案】CH4(g)+H2O(g)=CH3OH(g)+H2(g) △H=+77.0kJ·mol﹣1 0.12mol·L﹣1·min﹣1 0.18mol2·L﹣2 逆向 ![]() 0.8aL
0.8aL
【解析】
(1)Ⅰ、CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.0KJ/mol
Ⅱ、CO(g)+2H2(g)═CH3OH(g) △H=﹣129.0KJ/mol
将Ⅰ+Ⅱ得:CH4(g)+H2O(g)== CH3OH(g)+ H2(g) △H=+77.0kJ·mol﹣1
(2) 利用三段式我们可以进行以下
CH4(g)+H2O(g)═CO(g)+3H2(g)
起始量 1.0mol 2.0mol 0 0
变化量 0.4mol 0.4mol 0.4mol 1.2mol
平衡量0.6mol 1.6mol 0.4mol 1.2mol
①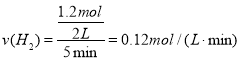 答案为:0.12mol·L﹣1·min﹣1
答案为:0.12mol·L﹣1·min﹣1
②![]() 答案为0.18mol2·L﹣2
答案为0.18mol2·L﹣2
若保持温度和容器的容积不变,5min时再向容器中充入H2O(g)和CO各0.2mol,则此时各物质的浓度为 c(CH4)=0.3mol/L,c(H2O)=0.9mol/L,c(CO)=0.3mol/L,c(H2)=0.6mol/L
![]() mol2·L﹣2>0.18mol2·L﹣2
mol2·L﹣2>0.18mol2·L﹣2
所以平衡应逆向移动。答案为逆向
(3)①设参加反应的CO物质的量为x
CO(g)+2H2(g)═CH3OH(g)
起始量 2mol 3mol 0
变化量 x 2x x
平衡量 2-x 3-2x x
![]() x=1mol
x=1mol
则平衡时A容器中H2的体积分数为![]() 答案为
答案为![]()
②若在平衡后打开K2,再次达到平衡后B容器的体积缩至0.6aL,则A、B 两容器内气体的总体积为1.6aL,相当于每个容器内的气体各为0.8aL。
故若打开K2之前,B容器的体积为0.8aL。
答案为0.8aL

 名校课堂系列答案
名校课堂系列答案【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )

容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度 | T1 | T2 | T2 |
反应物起始量 | 0.5molA 1.5molB | 0.5molA 1.5molB | 2.0molA 6.0molB |
A.由图可知:T1<T2,且该反应为吸热反应
B.T2时该反应的平衡常数K=0.8
C.物质A的化学计量数x=2
D.保持甲容器体积不变,向其中通入He气体,达到新平衡后,C的百分含量减小
【题目】以NaClO为有效成分的“84”消毒液在抗击新冠疫情的消杀工作中起到了重要作用。某研究小组设计下列实验探究NaClO的性质。
(已知:电离常数:![]() :
:![]() ,
,![]() ;
;![]() )
)
实验 | 装置 | 试剂(少量) | 预测可能的现象 |
① |
| 酚酞 | 无色溶液最终呈红色 |
② |
| 无明显现象 | |
③ | 淀粉 | 无色溶液立即变蓝 | |
④ |
| 溶液略呈浅绿色 |
结合上述实验探究,预测的现象以及解释均正确的是( )
A.实验①:NaClO溶液呈碱性:![]()
B.实验②:NaClO可用于制得![]()
C.实验③:NaClO具有氧化性:![]()
D.实验④:NaClO具有还原性:![]()