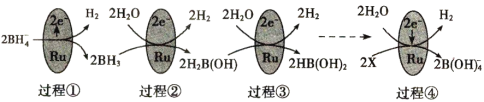
题目内容
【题目】已知3.25g金属Zn恰好与250mL某浓度的盐酸完全反应,计算:
(1)该盐酸的物质的量浓度;___________
(2)标准状况下,该反应生成的气体的体积。_____________
【答案】0.4mol/L 1.12L
【解析】
3.25g Zn的物质的量为![]() =0.05mol,再结合Zn+2HCl=ZnCl2+H2↑计算即可。
=0.05mol,再结合Zn+2HCl=ZnCl2+H2↑计算即可。
3.25g Zn的物质的量为![]() =0.05mol;
=0.05mol;
(1)由Zn+2HCl=ZnCl2+H2↑可知,参加反应的HCl的物质的量为2×n(Zn)=2×0.05mol=0.1mol,则该盐酸的物质的量浓度为![]() =0.4mol/L;
=0.4mol/L;
(2)由Zn+2HCl=ZnCl2+H2↑可知,反应生成的H2的物质的量为n(Zn)=0.05mol,则在标准状况下,反应生成的H2的气体的体积为0.05mol×22.4L/mol=1.12L。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )
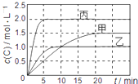
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度 | T1 | T2 | T2 |
反应物起始量 | 0.5molA 1.5molB | 0.5molA 1.5molB | 2.0molA 6.0molB |
A.由图可知:T1<T2,且该反应为吸热反应
B.T2时该反应的平衡常数K=0.8
C.物质A的化学计量数x=2
D.保持甲容器体积不变,向其中通入He气体,达到新平衡后,C的百分含量减小