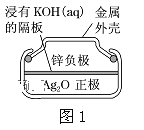
题目内容
【题目】在如图串联装置中,通电片刻即发现乙装置左侧电极表面出现红色固体,则下列说法不正确的是( )
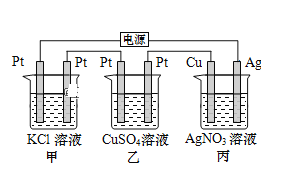
A.标准状况下当甲中产生4.48L气体时,丙中Cu电极质量增加21.6g
B.电解过程中丙中溶液pH无变化
C.向甲中加入适量的盐酸,可使溶液恢复到电解前的状态
D.乙中左侧电极反应式:Cu2++2e-=Cu
【答案】C
【解析】
通电片刻即发现乙装置左侧电极表面出现红色固体,则表明此电极中Cu2+获得电子生成铜,附着在电极表面,所以此电极为阴极。因为三个电池串联,所以各电池中左边电极都为阴极,右边电极都为阳极。
A. 甲装置为电解KCl的装置,阳极生成氯气,阴极生成氢气,标准状况下当甲中产生4.48L气体时,线路中转移电子0.2mol。丙中线路上转移电子也为0.2mol,Cu电极上析出0.2molAg,质量增加21.6g,正确 ;
B. 丙装置为电镀装置,电解后,AgNO3溶液的组成和浓度不变,电解过程中丙中溶液pH无变化,正确;
C. 甲中电解后,有一部分KCl转化为KOH,向甲中加入适量的盐酸,可使KOH转化为KCl,但溶液中的溶剂量增加,溶液浓度减小,不可能恢复到电解前的状态,错误;
D. 乙中左侧电极为阴极,电极反应式:Cu2++2e-=Cu,正确。
故答案为C。

 名校课堂系列答案
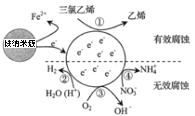
名校课堂系列答案【题目】草酸钴用途广泛,可用于指示剂和催化剂的制备。用含钴废料(主要成分为![]() ,还含有一定量的
,还含有一定量的![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等)制备草酸钴晶体
等)制备草酸钴晶体![]() 的工业流程如下图所示。请回答下列问题:
的工业流程如下图所示。请回答下列问题:
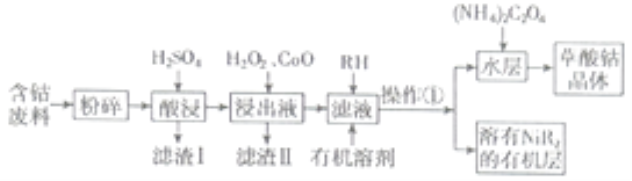
已知:①草酸钴晶体难溶于水
②![]() 为有机物(难电离)
为有机物(难电离)
③相关金属离子![]() 形成氢氧化物沉淀的
形成氢氧化物沉淀的![]() 范围如下:
范围如下:
金属离子 |
|
|
|
|
开始沉淀的 | 7.5 | 2.7 | 3.4 | 6.9 |
沉淀完全的 | 9.0 | 3.7 | 4.7 | 8.9 |
(1)滤渣Ⅰ的成分_______。
(2)![]() 是一种绿色氧化剂,写出加入
是一种绿色氧化剂,写出加入![]() 后溶液中发生的主要反应的离子方程式______。
后溶液中发生的主要反应的离子方程式______。
(3)加入氧化钴调节浸出液的![]() 的范围是______。
的范围是______。
(4)加入有机溶剂的目的是______。
(5)若仅从沉淀转化角度考虑,能否利用反应![]() 将
将![]() 转化为
转化为![]() ____(填“能”或“不能”),说明理由:______。(已知
____(填“能”或“不能”),说明理由:______。(已知![]() ,
,![]() )
)
(6)为测定制得的草酸钴晶体样品的纯度,现称取样品![]() ,先用适当试剂将其转化,稀释后得到纯净的草酸铵溶液
,先用适当试剂将其转化,稀释后得到纯净的草酸铵溶液![]() 。移取
。移取![]() 该溶液加入过量的稀硫酸酸化,用
该溶液加入过量的稀硫酸酸化,用![]() 高锰酸钾溶液滴定,当溶液由__________(填颜色变化),消耗高锰酸钾溶液
高锰酸钾溶液滴定,当溶液由__________(填颜色变化),消耗高锰酸钾溶液![]() ,计算草酸钴晶体样品的纯度为__________
,计算草酸钴晶体样品的纯度为__________![]() 。(用含
。(用含![]() 、
、![]() 、
、![]() 的代数式表示)(已知
的代数式表示)(已知![]() 的摩尔质量为
的摩尔质量为![]() )
)