题目内容
【题目】NaNO2是常用的一种防腐剂,其中+3价的N具有一定的氧化性。某实验小组利用以下反应2NO2+2NaOH=NaNO3+NaNO2+H2O制备NaNO2,并探究其性质。
I.制备NaNO2
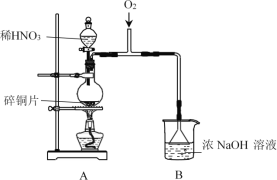
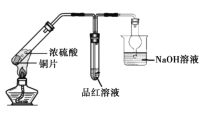
(1)A中发生反应的化学方程式是______。
(2)B中选用漏斗替代长直导管的优点是______。
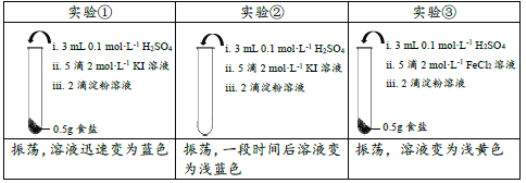
(3)为检验B中制得NaNO2,甲进行以下实验:
序号 | 试管 | 操作 | 现象 |
① | 2mLB中溶液 | 加2mL0.1mol/LKI溶液,滴加几滴淀粉溶液 | 不变蓝 |
② | 2mLB中溶液 | 滴加几滴H2SO4至pH=5,加2mL0.1mol/LKI溶液,滴加几滴淀粉溶液 | 变蓝 |
③ | 2mLH2O | 滴加几滴H2SO4至pH=5,加2mL0.1mol/LKI溶液,滴加几滴淀粉溶液 | 不变蓝 |
实验③的目的是_______。
(4)乙认为上述3组实验无法证明B中一定含NaNO2,还需补充实验,理由是______。
II.探究NaNO2的性质
装置 | 操作 | 现象 |
| 取10mL1mol/LNaNO2溶液于试剂瓶中,加入几滴H2SO4酸化,再加入10mL1mol·L-1FeSO4溶液,迅速塞上橡胶塞,缓缓通入足量O2。 | i.溶液迅速变为棕色; ii.溶液逐渐变浅,有无色气泡产生,溶液上方为浅红棕色。 iii.最终形成棕褐色溶液。 |
资料:i.
ii.HNO2在溶液中不稳定,易分解产生NO和NO2气体。
(5)现象i溶液变为棕色的原因是______。
(6)已知现象ii棕色溶液变浅是由于生成了Fe3+,反应的离子方程式是______。
【答案】3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 扩大了气体与NaOH的接触面积,使反应快速发生,同时又可防止由于气体溶解而产生的倒吸现象的发生 溶液中c(I-)和c(H+)相同时,前者溶液变为蓝色,后者不变蓝色,证明空气中O2不会氧化I-的目的 若NO2的物质的量比NO多,还会发生反应:2NO2+2NaOH=NaNO3+NaNO2+H2O,这样得到的溶液中含有NaNO3,酸性条件下NO3-可能也会氧化I-产生I2而产生干扰 NaNO2与稀硫酸反应产生HNO2,离子方程式为:NO2-+H+HNO2,HNO2不稳定,分解产生NO,NO与FeSO4溶液中的Fe2+结合形成[Fe(NO)]2+,使溶液呈棕色 4[Fe(NO)]2++4H++O2=4NO+4Fe3++2H2O
【解析】
Cu与稀硝酸反应产生Cu(NO3)2、NO、H2O,NO与O2反应产生NO2,NO、NO2被氢氧化钠溶液吸收得到NaNO2和水,为防止倒吸现象,在导气管末端安装了一个倒扣的漏斗,NaNO2在酸性条件下可以将KI氧化为I2而使淀粉溶液变为蓝色,据此检验NaNO2的存在,若气体中NO2过量,与碱反应产生NaNO3,在酸性条件下NO3-也可以氧化I-为I2而会产生干扰;根据[Fe(NO)]2+在溶液中呈棕色分析溶液颜色变化;[Fe(NO)]2+具有还原性,会被氧气氧化产生Fe3+使溶液颜色变浅。
(1)A中Cu与稀硝酸反应产生Cu(NO3)2、NO、H2O,根据电子守恒、原子守恒,可得发生反应的化学方程式是3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(2)B中选用漏斗替代长直导管的优点是:扩大了气体与NaOH的接触面积,使反应快速发生,同时又可防止由于气体溶解而产生的倒吸现象的发生;
(3)实验③和实验②比较,溶液中c(I-)和c(H+)相同时,前者溶液变为蓝色,后者不变蓝色,证明空气中O2不会氧化I-的目的;
(4)在装置A中反应产生NO,有一部分NO与通入的O2反应产生NO2,若通入NaOH溶液中NO、NO2的物质的量相等,就会发生反应:NO+NO2+2NaOH=NaNO2+H2O,若NO2的物质的量比NO多,还会发生反应:2NO2+2NaOH=NaNO3+NaNO2+H2O,这样得到的溶液中含有NaNO3,酸性条件下NO3-可能也会氧化I-产生I2而产生干扰,因此需要补做实验;
(5)NaNO2与稀硫酸反应产生HNO2,离子方程式为:NO2-+H+HNO2,HNO2不稳定,分解产生NO,NO与FeSO4溶液中的Fe2+结合形成[Fe(NO)]2+,使溶液呈棕色;
(6)[Fe(NO)]2+具有还原性,会被溶解在酸性溶液中O2氧化产生Fe3+,同时得到NO,导致溶液逐渐变浅,有无色气泡产生,在溶液上方变为浅红棕色气体,根据元素守恒和电荷守恒配平离子方程式,离子反应为:4[Fe(NO)]2++4H++O2=4NO+4Fe3++2H2O。