��Ŀ����
����Ŀ��������������ˮ��ɱ����������������ʱ�����һЩ����Ӱ�죬������ǿ�ʼ�о�һЩ��������ˮ��������ijѧϰС��������Ϸ���NCl3����Ϊɱ������������С��������ͼ��ʾ��װ���Ʊ�NCl3 �� ��̽��NCl3��Ư���ԣ�NCl3������������£�
�������� | �Ʊ�ԭ�� | ��ѧ���� |
��ɫ��״Һ�壬�۵�Ϊ��40�棬�е�Ϊ71�棬��������ˮ���������л��ܼ����ܶ�Ϊ1.65g/mL | Cl2��NH4Clˮ��Һ�ڵ����·�Ӧ | 95�汬ը����ˮ�з���ˮ�� |
�ش��������⣺
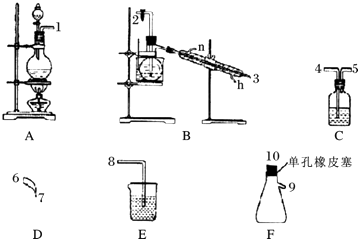
��1������ʵ��Ŀ�ģ��ӿ����ӵ�˳��Ϊ1������2��3��6��7����
��2��Cװ����ʢ�ŵ��Լ�Ϊ����ʳ��ˮ��Eװ����ʢ�ŵ��Լ�Ϊ ��
��3��Aװ���з�����Ӧ�����ӷ���ʽΪ ��
��4��Bװ���з�����Ӧ�Ļ�ѧ����ʽΪ �� ��Bװ��������ƿ�г��ֽ϶���״Һ��رսӿ�2���Ļ���������ˮԡ���ȵ��¶�Ϊ ��
��5����Fװ�õ���ƿ���н϶��ɫ��״Һ�����ʱ���ø���ྻ�IJ�����պȡ��Һ��ε�����ĺ�ɫʯ����ֽ�ϣ���ֽ����ɫ����ȡ��Һ�����50��60����ˮ�У�Ƭ�̺�ȡ����ˮ�ٵε�����ĺ�ɫʯ����ֽ�ϣ���ֽ�ȱ�������ɫ����Ϸ�Ӧ����ʽ�������� ��
���𰸡�
��1��4��5��10��9��8
��2��NaOH��Һ
��3��MnO2+4H++2Cl�� ![]() Mn2++Cl2��+2H2O
Mn2++Cl2��+2H2O
��4��3Cl2+NH4Cl�TNCl3+4HCl��71��95��
��5��NCl3+3H2O ![]() 3HClO+NH3��NCl3������Ư���ԣ�NCl3����ˮ��ˮ������NH3?H2Oʹ��ɫʯ����ֽ���������ɵ�HClO��ʹ��Ư����ɫ
3HClO+NH3��NCl3������Ư���ԣ�NCl3����ˮ��ˮ������NH3?H2Oʹ��ɫʯ����ֽ���������ɵ�HClO��ʹ��Ư����ɫ
���������⣺��1��Aװ���Ʊ��������Ʊ��������к���HCl��ˮ�������ñ���ʳ��ˮ��ȥHCl��Bװ����Cl2��NH4Clˮ��Һ�ڵ����·�Ӧ�õ�NCl3 �� ���������������ռ�NCl3 �� ���������������Һ����β������ֹ��Ⱦ�������������ӿ����ӵ�˳��Ϊ��1��4��5��2��3��6��7��10��9��8�����Դ��ǣ�4��5 10��9��8����2���������Ȼ��ⶼ�����������Ⱦ������ֱ���ŷţ�����������������Һ���գ�����E��ʢ������������Һ�����Դ��ǣ�NaOH��Һ����3������������Ũ�����ڼ��������·�Ӧ�����Ȼ��̡�������ˮ�����ӷ���ʽ��MnO2+4H++2Cl�� ![]() Mn2++Cl2��+2H2O�����Դ��ǣ�MnO2+4H++2Cl��
Mn2++Cl2��+2H2O�����Դ��ǣ�MnO2+4H++2Cl�� ![]() Mn2++Cl2��+2H2O����4��Bװ����Cl2��NH4Clˮ��Һ�ڵ����·�Ӧ�õ�NCl3 �� ������HCl����Ӧ����ʽΪ��3Cl2+NH4Cl�TNCl3+4HCl�����������NCl3 �� NCl3�ķе�Ϊ71�棬��95�汬ը������Ӧ���������¶�Ϊ71��95�棬���Դ��ǣ�3Cl2+NH4Cl�TNCl3+4HCl��71��95�棻3Cl2+NH4Cl�TNCl3+4HCl�� 71��95�棻��5��NCl3������Ư���ԣ���ˮ��Ӧ���ɴ�����Ͱ�������ѧ����ʽ��NCl3+3H2O
Mn2++Cl2��+2H2O����4��Bװ����Cl2��NH4Clˮ��Һ�ڵ����·�Ӧ�õ�NCl3 �� ������HCl����Ӧ����ʽΪ��3Cl2+NH4Cl�TNCl3+4HCl�����������NCl3 �� NCl3�ķе�Ϊ71�棬��95�汬ը������Ӧ���������¶�Ϊ71��95�棬���Դ��ǣ�3Cl2+NH4Cl�TNCl3+4HCl��71��95�棻3Cl2+NH4Cl�TNCl3+4HCl�� 71��95�棻��5��NCl3������Ư���ԣ���ˮ��Ӧ���ɴ�����Ͱ�������ѧ����ʽ��NCl3+3H2O ![]() 3HClO+NH3����������ˮ��Ӧ����һˮ�ϰ���һˮ�ϰ���������������ӣ���Һ�Լ��ԣ�ʹ��ɫʯ����ֽ���������ɵ�HClO��ʹ��Ư����ɫ�� ���Դ��ǣ�NCl3+3H2O
3HClO+NH3����������ˮ��Ӧ����һˮ�ϰ���һˮ�ϰ���������������ӣ���Һ�Լ��ԣ�ʹ��ɫʯ����ֽ���������ɵ�HClO��ʹ��Ư����ɫ�� ���Դ��ǣ�NCl3+3H2O ![]() 3HClO+NH3��NCl3������Ư���ԣ�NCl3����ˮ��ˮ������NH3H2Oʹ��ɫʯ����ֽ���������ɵ�HClO��ʹ��Ư����ɫ��
3HClO+NH3��NCl3������Ư���ԣ�NCl3����ˮ��ˮ������NH3H2Oʹ��ɫʯ����ֽ���������ɵ�HClO��ʹ��Ư����ɫ��
�����㾫����������Ĺؼ���������������ʵ�����Ʒ������֪ʶ������ʵ�����Ʒ���MnO2+4HCl��Ũ��=MnCl2+Cl2��+2H2O��