题目内容
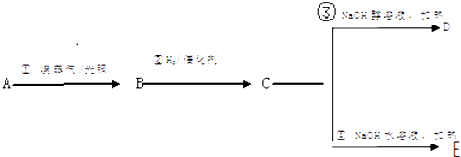
【题目】利用下图装置可以验证非金属性的变化规律。

(1)仪器A的名称为_____________________,干燥管D的作用是______________________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、_______、_______,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为__________________________________。
【答案】 分液漏斗 防止倒吸 浓盐酸 KMnO4 Na2S S2-+Cl2===S↓+2Cl-
【解析】(1)仪器A为分液漏斗,球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中;正确答案:分液漏斗;防止倒吸。
(2)设计实验验证非金属性:![]() ,利用氯气与
,利用氯气与![]() 的氧化还原反应可验证,则装置A、B、C中所装药品应分别为浓盐酸、
的氧化还原反应可验证,则装置A、B、C中所装药品应分别为浓盐酸、![]() 、
、![]() 溶液,装置C中的实验现象为有淡黄色沉淀生成,装置C中发生反应的离子方程式为
溶液,装置C中的实验现象为有淡黄色沉淀生成,装置C中发生反应的离子方程式为![]() ═S↓
═S↓![]() ;正确答案:浓盐酸 ; KMnO4; Na2S ; S2-+Cl2===S↓+2Cl-。
;正确答案:浓盐酸 ; KMnO4; Na2S ; S2-+Cl2===S↓+2Cl-。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂.某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3 , 并探究NCl3的漂白性.NCl3的相关性质如下:
物理性质 | 制备原理 | 化学性质 |
黄色油状液体,熔点为﹣40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中发生水解 |
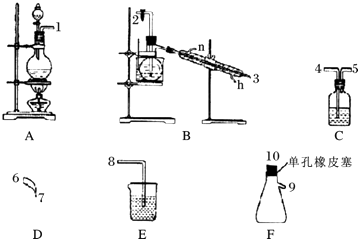
回答下列问题:
(1)根据实验目的,接口连接的顺序为1﹣﹣﹣2﹣3﹣6﹣7﹣﹣
(2)C装置中盛放的试剂为饱和食盐水,E装置中盛放的试剂为 .
(3)A装置中发生反应的离子方程式为 .
(4)B装置中发生反应的化学方程式为 , 当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为 .
(5)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50﹣60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,结合反应方程式解释该现象: .