题目内容
【题目】将一定量的A12O3固体加入100mLNaOH溶液中,固体全部溶解,向所得溶液中逐滴加入1.0 molL-1盐酸,所得沉淀的物质的量与加入盐酸体积的关系如图所示(不考虑溶液体积的变化),则下列说法正确的是

A. 原NaOH溶液的浓度为1.0mol/L B. 原A12O3的质量为0.51g
C. V0的数值为35 D. 沉淀量达到最大时,溶液的溶质有两种
【答案】B
【解析】A、沉淀量最大时是氯化钠的水溶液,n(HCl)=1.0molL-1×0.05L=0.05mol,所以n(NaOH)=n(HCl)=0.05mol,则NaOH溶液的物质的量浓度是0.05mol÷0.1L=0.5mol/L,A错误;B、50mL→80mL发生反应
Al(OH)3+3H+=Al3++3H2O
1mol 3mol
n[Al(OH)3] 0.03mol
所以n[Al(OH)3]=0.01mol,则n(Al2O3)=1/2×0.01=0.005mol,所以m(Al2O3)=0.005mol×102g/mol=0.51g,B正确;C、偏铝酸钠与盐酸生成氢氧化铝消耗的盐酸是氢氧化铝与盐酸反应消耗的盐酸的1/3,所以V0→50的体积为10mL,则V0=40mL,C错误;D、沉淀量达到最大时,是氯化钠的水溶液,而不是两种溶质,D错误;答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
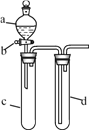
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是__________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是______________________________________。再由a向c中加2 mL蒸馏水,c中的实验现象是____________________________。
(3)右表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____,理由是_________。
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2,操作步骤为_______________,实验现象为__________________;但此实验的不足之处是____________________________。
【题目】氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂.某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3 , 并探究NCl3的漂白性.NCl3的相关性质如下:
物理性质 | 制备原理 | 化学性质 |
黄色油状液体,熔点为﹣40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中发生水解 |
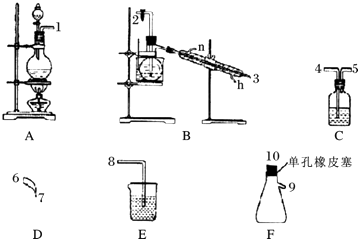
回答下列问题:
(1)根据实验目的,接口连接的顺序为1﹣﹣﹣2﹣3﹣6﹣7﹣﹣
(2)C装置中盛放的试剂为饱和食盐水,E装置中盛放的试剂为 .
(3)A装置中发生反应的离子方程式为 .
(4)B装置中发生反应的化学方程式为 , 当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为 .
(5)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50﹣60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,结合反应方程式解释该现象: .