题目内容
磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池的电极材料。某化工厂以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如下: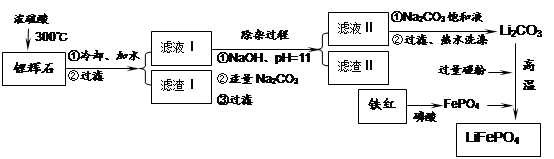
已知:2LiAl(SiO3)2 + H2SO4(浓) 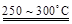 Li2SO4 + Al2O3·4SiO2·H2O↓
Li2SO4 + Al2O3·4SiO2·H2O↓
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣Ⅰ中可分离出Al2O3,如下图所示。请写出生成沉淀的离子方程式 。
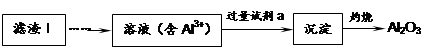
(2)滤渣Ⅱ的主要成分是: (填化学式)。
(3)向滤液Ⅱ中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(4)写出在高温下生成磷酸亚铁锂的化学方程式 。
(5)磷酸亚铁锂电池总反应为:FePO4+Li
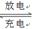 LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应: 。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为 。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应: 。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为 。
(1)Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (2分)
(2)Mg(OH)2、CaCO3(共4分,对一个得2分,答错不得分,但不倒扣分)
(3)Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失(2分)
(4)2FePO4+ Li2CO3+2C  2LiFePO4+3CO↑(2分)
2LiFePO4+3CO↑(2分)
(5)FePO4+Li++e-=LiFePO4(2分);1.4g(2分)
解析试题分析:(1)由已知化学方程式可知,滤渣Ⅰ的主要成分是Al2O3·4SiO2·H2O,要通过灼烧沉淀生成氧化铝,故沉淀为氢氧化铝,则必须加入过量的弱碱,如氨水;(2)锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐),故用氢氧化钠先中和过量的浓硫酸,再调高pH值,使镁离子变成氢氧化镁沉淀析出,钙离子则通过加入碳酸钠,生成碳酸钙沉淀析出,故滤渣Ⅱ的主要成分是Mg(OH)2、CaCO3;(3)由表中数据可知,Li2CO3的溶解度随温度升高而减小,故通过热水洗涤可减少碳酸锂的损失;(4)因加入过量碳粉,故碳粉必定不能完全反应,因此生成一氧化碳,而非二氧化碳,根据得失电子守恒进行配平;(5)电池放电时,正极发生还原反应,电极反应式为FePO4+Li++e-=LiFePO4;当电解饱和食盐水时,阳极为氯离子在放电,产生氯气,阴极为氢离子在放电,产生氢气,当两极共有4480mL气体产生,即0.1mol氯气和0.1mol氢气,转移0.2mol电子,相当于消耗0.2mol的锂,质量为1.4g。
考点:化学与化工生产
点评:化工生产跟人类的生活息息相关,它是化学在现实生活中的最有用的应用,近年来化工生产在高考中的分量逐渐增大,考生在备考过程中应注意联系实际,学以致用。难度较大。

尿素是第一个人工合成的有机物,下列关于尿素的叙述不正确的是 ( )。
| A.尿素是一种氮肥 |
| B.尿素是人体新陈代谢的一种产物 |
| C.尿素能发生水解反应 |
| D.尿素是一种酸性物质 |
在接触法产生H2SO4的过程中,对“废气、废水、废渣、废热”的处理正确的是( )
①废气用氨水处理 ②污水用石灰乳处理 ③废渣用来造水泥或炼铁 ④设置“废热”锅炉产生蒸气来供热或发电
| A.只有①② | B.只有①③④ | C.只有①②③ | D.全部 |

 Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓



 2H2(g)+S2(g),其平衡常数表达式为K=。
2H2(g)+S2(g),其平衡常数表达式为K=。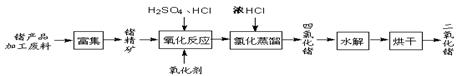


 BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)