题目内容
6.FeS2可在Fe2(SO4)3溶液中“溶解”,硫元素都以SO42-形式存在,请完成该反应的化学方程式.1FeS2+7Fe2(SO4)3+8H2O→15FeSO4+8H2SO4.
分析 反应中二硫化亚铁中的硫元素化合价从-1价升高到硫酸根离子中的+6价,三价铁离子降为二价铁离子,依据得失电子守恒结合原子个数守恒配平方程式.
解答 解:反应中二硫化亚铁中的硫元素化合价从-1价升高到硫酸根离子中的+6价,硫酸铁中铁元素从+3价降低到+2价,要使氧化剂、还原剂得失电子守恒,则硫化亚铁系数为1,硫酸铁系数为7,依据原子个数守恒,反应方程式为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,
故答案为:1;7;8H2O;15;8H2SO4.
点评 本题考查了氧化还原反应方程式的书写,明确氧化还原反应中得失电子守恒规律,准确判断各元素的化合价变化情况是解题关键,题目难度不大.

练习册系列答案
相关题目
16.下列物质在给定条件下同分异构体数目正确的是( )
| A. | C4H10属于烷烃的同分异构体有3种 | |
| B. | 分子组成是C5H10O2属于羧酸的同分异构体有5种 | |
| C. | 分子组成是C4H80属于醛类的同分异构体有3种 | |
| D. | 结构为 的一溴代物有5种 的一溴代物有5种 |
17.X、Y、Z、W、M是元素周期表中原子序数依次增大的五种元素,其相关信息如表:
(1)W位于元素周期表第三周期第ⅢA族;W的简单离子半径比Z的简单离子半径小(填“大’’或“小”).
(2)Z原子的第一电离能比氧原子的大(填“大”或“小”);M的基态原子价电子排布式是
3d104s1
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是3:2,空间构型是直线型
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途:制硝酸、作制冷剂;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
(5)可用YX4还原ZOx以消除其污染.已知:
YX4 (g)+4ZO2 (g)=4ZO(g)+YO2(g)+2X2O(g)△H=-574kJ•mol-1
YX4 (g)+4ZO(g)=2Z2 (g)十YO2 (g)+2X2O(g)△H=-1160kJ•mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1.
| 元素 | 相关信息 |
| X | 元素周期表中核电荷数最小的元素 |
| y | Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质 |
| Z | Z是大气中含量多的元素,其某些氧化物为大气中常见的污染物 |
| W | W是地壳中含量最高的金属元素 |
| M | 常见金属,单质呈紫红色 |
(2)Z原子的第一电离能比氧原子的大(填“大”或“小”);M的基态原子价电子排布式是
3d104s1
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是3:2,空间构型是直线型
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途:制硝酸、作制冷剂;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
(5)可用YX4还原ZOx以消除其污染.已知:
YX4 (g)+4ZO2 (g)=4ZO(g)+YO2(g)+2X2O(g)△H=-574kJ•mol-1
YX4 (g)+4ZO(g)=2Z2 (g)十YO2 (g)+2X2O(g)△H=-1160kJ•mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1.
14.A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物.而辛是由C元素形成的单质.已知;甲+乙=丁+辛,甲+丙=戊+辛;常温下0.1mol•L-1丁溶液的pH为13,则下列说法正确的是( )
| A. | 元素B、C、D的原子半径由大到小的顺序为:r(D)>r(C)>r(B) | |
| B. | C的单质在点燃条件分别与A、B、D的单质化合,所得化合物均存在共价键 | |
| C. | 四种元素的单质中,熔沸点最高的是D的单质 | |
| D. | C和D所形成离子的电子层结构一定相同 |
1.如表实验所用的试剂不合理的是( )
| 选项 | 实验目的 | 所用试剂 |
| A | 比较Fe3+和Cu2+的氧化性 | FeCl3溶液和Cu |
| B | 比较镁和铝的金属性 | MgCl2溶液、AlCl3溶液、NaOH溶液 |
| C | 比较硫和氯的非金属性 | 氢硫酸、氯气 |
| D | 比较苯酚和碳酸的酸性 | 0.1mol/L苯酚钠、0.1mol/L碳酸钠溶液pH试纸 |
| A. | A | B. | B | C. | C | D. | D |
11.常温下,有下列4中溶液,下列说法正确的是( )
| ① | ② | ③ | ④ |
| 0.1 mol/L-1 CH3COOH溶液 | pH=3 CH3COOH 溶液 | 0.1 mol/L-1 NaOH溶液 | pH=11 NaOH溶液 |
| A. | 由水电离出的c(H+):③>① | |
| B. | ①稀释到原来的100倍后,pH与②相同 | |
| C. | ①与③混合,若溶液pH=7,则两溶液的体积:③>① | |
| D. | ②与④混合,若溶液pH=7,则两溶液的体积:④>② |
18.混合下列各组物质使之充分反应,将所得混合物加热蒸干,并在300℃灼烧至质量不变为止,最终残留固体为纯净物的是( )
| A. | 向CuSO4溶液中加入适量铁粉 | B. | 等浓度等体积的(NH4)2SO4和BaCl2 | ||
| C. | 等物质的量的NaHCO3和Na2O2 | D. | 在NaBr溶液中通入过量的Cl2 |
7.如图所示,φ(X)为气态反应物在平衡混合物中的体积分数,T为温度.符合该曲线的反应是( )
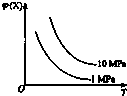

| A. | 2NH3(g)?N2(g)+3H2(g)(正反应为吸热反应) | |
| B. | H2(g)+I2(g)?2HI(g)(正反应为放热反应) | |
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)(正反应为放热反应) | |
| D. | 2SO2(g)+O2(g)?2SO3(正反应为放热反应) |