题目内容
3.反应A(气)+B(固)?C(气),在其他条件不变时,改变其中一个条件,则生成C的速率(选填“加快”“减慢”或“不变”):(1)升温加快
(2)降温减慢
(3)增大压强加快
(4)增大容器容积减慢
(5)加入A加快
(6)加入B不变
(7)加催化剂加快.
分析 该反应是一个反应前后气体体积不变的可逆反应,升高温度、增大压强、增大气体反应物浓度、加入催化剂都加快反应速率,据此分析解答.
解答 解:该反应是一个反应前后气体体积不变的可逆反应,升高温度、增大压强、增大气体反应物浓度、加入催化剂都加快反应速率,
(1)升温增大活化分子百分含量,所以加快反应速率,故答案为:加快;
(2)降温减小活化分子百分含量,所以减慢反应速率,故答案为:减慢;
(3)增大压强,单位体积内活化分子数增多,所以加快反应速率,故答案为:加快;
(4)增大容器容积,单位体积内活化分子数减少,所以反应速率减慢,故答案为:减慢;
(5)加入A时,A浓度增大,反应速率加快,故答案为:加快;
(6)加入B时,B是固体浓度不变,所以反应速率不变,故答案为:不变;
(7)加入催化剂,增大活化分子百分含量,所以反应速率加快,故答案为:加快.
点评 本题考查化学反应速率影响因素,明确哪些因素影响反应速率及其影响原理是解本题关键,注意固体、纯液体不影响反应速率,题目难度不大.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
14.A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物.而辛是由C元素形成的单质.已知;甲+乙=丁+辛,甲+丙=戊+辛;常温下0.1mol•L-1丁溶液的pH为13,则下列说法正确的是( )
| A. | 元素B、C、D的原子半径由大到小的顺序为:r(D)>r(C)>r(B) | |
| B. | C的单质在点燃条件分别与A、B、D的单质化合,所得化合物均存在共价键 | |
| C. | 四种元素的单质中,熔沸点最高的是D的单质 | |
| D. | C和D所形成离子的电子层结构一定相同 |
11.常温下,有下列4中溶液,下列说法正确的是( )
| ① | ② | ③ | ④ |
| 0.1 mol/L-1 CH3COOH溶液 | pH=3 CH3COOH 溶液 | 0.1 mol/L-1 NaOH溶液 | pH=11 NaOH溶液 |
| A. | 由水电离出的c(H+):③>① | |
| B. | ①稀释到原来的100倍后,pH与②相同 | |
| C. | ①与③混合,若溶液pH=7,则两溶液的体积:③>① | |
| D. | ②与④混合,若溶液pH=7,则两溶液的体积:④>② |
18.混合下列各组物质使之充分反应,将所得混合物加热蒸干,并在300℃灼烧至质量不变为止,最终残留固体为纯净物的是( )
| A. | 向CuSO4溶液中加入适量铁粉 | B. | 等浓度等体积的(NH4)2SO4和BaCl2 | ||
| C. | 等物质的量的NaHCO3和Na2O2 | D. | 在NaBr溶液中通入过量的Cl2 |
7.如图所示,φ(X)为气态反应物在平衡混合物中的体积分数,T为温度.符合该曲线的反应是( )
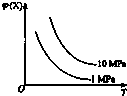

| A. | 2NH3(g)?N2(g)+3H2(g)(正反应为吸热反应) | |
| B. | H2(g)+I2(g)?2HI(g)(正反应为放热反应) | |
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)(正反应为放热反应) | |
| D. | 2SO2(g)+O2(g)?2SO3(正反应为放热反应) |
5.已知反应A2(g)+2B2(g)?2AB2(g)△H<0,下列说法正确的( )
| A. | 升高温度,正向反应速率增加,逆向反应速率减小 | |
| B. | 升高温度有利于反应速率增加,从而缩短达到平衡的时间 | |
| C. | 若反应在密闭体系内进行,通入He气,体系压强增大,反应速率增大 | |
| D. | 若反应在恒压体系内进行,通往He气,体系压强不变,反应速率不变 |
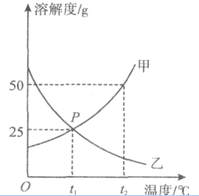 如图为甲、乙两种物质的溶解度曲线图,请根据图回答下列问题.
如图为甲、乙两种物质的溶解度曲线图,请根据图回答下列问题.