题目内容
5.某学习兴趣小组讨论辨析以下说法,其中说法正确的是( )①通过化学变化可以实现16O与18O间的相互转化;
②向Fe(OH)3胶体中逐渐滴入过量的稀硫酸,能发生“先沉淀后溶解”的现象;
③向无色溶液中滴加盐酸生成能使澄清石灰水变浑浊的无色气体,证明溶液一定含CO32-或者HCO3-;
④Na、S、C分别跟氧气反应均能得到两种不同的氧化物;
⑤等物质的量的Na2O、Na2O2阴离子数之比为1:2;
⑥加入铝粉后产生大量氢气的溶液中,NH4+、Na+、NO3-、CI-可以大量共存.
| A. | ②⑥ | B. | ②④⑤ | C. | ② | D. | ②④⑥ |
分析 ①化学变化的实质:分子的分裂,原子的重新组合;
②根据胶体的性质判断,加入稀硫酸产生聚沉现象,H2SO4与Fe(OH)3反应,所以出现先沉淀后溶解现象;
③能使澄清石灰水变浑浊的无色气体可能是二氧化硫;
④S在氧气中点燃只能生成二氧化硫;
⑤Na2O2和Na2O两种物质中的阴离子分别是过氧根离子和氧离子;
⑥能与铝片反应生成氢气的溶液可能呈碱性,也可能呈酸性,分别判断在碱性或酸性条件下离子之间能否发生反应.
解答 解:16O与18O互为同位素,二者不需要通过化学变化实现,故①错误,
向Fe(OH)3胶体中逐滴滴入过量的稀硫酸,先发生胶体的聚沉,继续加入硫酸,发生酸碱中和反应,Fe(OH)3溶解,故②正确;
若溶液中含有CO32-、HCO3-、SO32-、HSO3-等离子时,与盐酸反应产生能够使澄清石灰水变浑浊的无色气体,故③错误;
S跟氧气反应只生成SO2,故④错误;
等物质的量的Na2O、Na2O2阴离子数之比为1:1,故⑤错误,
加入铝粉能够生成氢气的溶液可能是强酸性或强碱性溶液,强酸性条件下,NO3-具有强氧化性,不能生成氢气,强碱性条件下,NH4+不能大量共存,故⑥错误;
故选C.
点评 本题主要考查的是同位素性质、胶体的性质、离子共存等知识点,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.合成二甲醚的三步反应如下:
2H2(g)+CO(g)?CH3OH(g)△H1
2CH3OH (g)?CH3OCH3 (g)+H2O(g)△H2
CO(g)+H2O(g)?CO2(g)+H2(g)△H3
则 3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g) 的△H是( )
2H2(g)+CO(g)?CH3OH(g)△H1
2CH3OH (g)?CH3OCH3 (g)+H2O(g)△H2
CO(g)+H2O(g)?CO2(g)+H2(g)△H3
则 3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g) 的△H是( )
| A. | △H=2△H1+△H2+△H3 | B. | △H=△H1+△H2+△H3 | ||
| C. | △H=△H1+2△H2+2△H3 | D. | △H=2△H1+△H2-△H3 |
16.下列物质在给定条件下同分异构体数目正确的是( )
| A. | C4H10属于烷烃的同分异构体有3种 | |
| B. | 分子组成是C5H10O2属于羧酸的同分异构体有5种 | |
| C. | 分子组成是C4H80属于醛类的同分异构体有3种 | |
| D. | 结构为 的一溴代物有5种 的一溴代物有5种 |
20.与下列事实对应的化学用语错误是( )
| A. | 纯碱溶液能清洗油污:CO32-+H2O?HCO3-+OH- | |
| B. | 配制FeSO4溶液时加入适量的铁粉:Fe3++Fe→2Fe2+ | |
| C. | 含1molNaOH和1molNa2CO3的混合溶液中滴入含1.5molHCl的稀盐酸:2OH-+CO32-+3H+→HCO3-+2H2O | |
| D. | NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-→2BaSO4↓+AlO2-+2H2O |
10.下列反应的离子方程式书写正确的是( )
| A. | 向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO | |
| B. | Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe2++Fe3++4H2O | |
| C. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| D. | 溶液中FeBr2与等物质的量的Cl2反应:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+Br2 |
17.X、Y、Z、W、M是元素周期表中原子序数依次增大的五种元素,其相关信息如表:
(1)W位于元素周期表第三周期第ⅢA族;W的简单离子半径比Z的简单离子半径小(填“大’’或“小”).
(2)Z原子的第一电离能比氧原子的大(填“大”或“小”);M的基态原子价电子排布式是
3d104s1
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是3:2,空间构型是直线型
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途:制硝酸、作制冷剂;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
(5)可用YX4还原ZOx以消除其污染.已知:
YX4 (g)+4ZO2 (g)=4ZO(g)+YO2(g)+2X2O(g)△H=-574kJ•mol-1
YX4 (g)+4ZO(g)=2Z2 (g)十YO2 (g)+2X2O(g)△H=-1160kJ•mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1.
| 元素 | 相关信息 |
| X | 元素周期表中核电荷数最小的元素 |
| y | Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质 |
| Z | Z是大气中含量多的元素,其某些氧化物为大气中常见的污染物 |
| W | W是地壳中含量最高的金属元素 |
| M | 常见金属,单质呈紫红色 |
(2)Z原子的第一电离能比氧原子的大(填“大”或“小”);M的基态原子价电子排布式是
3d104s1
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是3:2,空间构型是直线型
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途:制硝酸、作制冷剂;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
(5)可用YX4还原ZOx以消除其污染.已知:
YX4 (g)+4ZO2 (g)=4ZO(g)+YO2(g)+2X2O(g)△H=-574kJ•mol-1
YX4 (g)+4ZO(g)=2Z2 (g)十YO2 (g)+2X2O(g)△H=-1160kJ•mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1.
14.A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物.而辛是由C元素形成的单质.已知;甲+乙=丁+辛,甲+丙=戊+辛;常温下0.1mol•L-1丁溶液的pH为13,则下列说法正确的是( )
| A. | 元素B、C、D的原子半径由大到小的顺序为:r(D)>r(C)>r(B) | |
| B. | C的单质在点燃条件分别与A、B、D的单质化合,所得化合物均存在共价键 | |
| C. | 四种元素的单质中,熔沸点最高的是D的单质 | |
| D. | C和D所形成离子的电子层结构一定相同 |
7.如图所示,φ(X)为气态反应物在平衡混合物中的体积分数,T为温度.符合该曲线的反应是( )
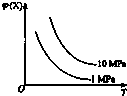

| A. | 2NH3(g)?N2(g)+3H2(g)(正反应为吸热反应) | |
| B. | H2(g)+I2(g)?2HI(g)(正反应为放热反应) | |
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)(正反应为放热反应) | |
| D. | 2SO2(g)+O2(g)?2SO3(正反应为放热反应) |