题目内容
16.在同温同压下,下列各组热化学方程式中,△H2>△H 1的是( )| A. | 2H2(g)+O2(g)=2H2O(g),△H 1;2H2(g)+O2(g)=2H2O(l),△H2 | |
| B. | S(g)+O2(g)=SO2(g),△H 1;S(s)+O2(g)=SO2(g),△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO(g),△H 1;C(s)+O2(g)=CO2(g),△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g),△H 1;2H2(g)+2Cl2(g)=4HCl(g)△H2 |
分析 A、液态水变为气态水的过程是吸热过程;
B、固体硫变为气态硫需要吸收热量;
C、碳单质完全燃烧放热多于不完全燃烧放的热;
D、化学反应方程式的系数加倍,焓变数值加倍.
解答 解:A、物质的燃烧反应是放热的,所以焓变是负值,液态水变为气态水的过程是吸热的,故△H1>△H2,故A错误;
B、物质的燃烧反应是放热的,所以焓变是负值,固体硫变为气态硫需要吸收热量,所以△H1<△H2,故B正确;
C、碳单质完全燃烧生成二氧化碳放热多于不完全燃烧生成一氧化碳放的热,反应的焓变是负值,故△H1>△H2,故C错误;
D、化学反应方程式的系数加倍,焓变数值加倍,该化合反应是放热的,所以焓变值是负值,2△H1=△H2,△H1>△H2,故D错误;
故选B.
点评 本题考查了物质反应能量变化分析判断,主要是盖斯定律的应用,物质量不同、状态不同、产物不同,反应的能量变化本题,题目较简单.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
14.下列有关盐酸和醋酸的叙述中错误的是( )
| A. | 常温下,等物质的量浓度的盐酸和醋酸分别与铁粉反应,盐酸的速率比醋酸的快 | |
| B. | 盐酸中存在电离平衡:HCl?Cl-+H+ | |
| C. | 常温下,若c(H+)相同时,c(HCl)比c(CH3COOH)大 | |
| D. | 同为0.1 mol/L的盐酸和醋酸,盐酸的导电性比醋酸的强 |
7.实验室用NaCl固体配200mL 1.0mol/L NaCl溶液,下列判断不对的是( )
| A. | 用托盘天平称取NaCl固体11.7g | |
| B. | 应选用250 mL的容量瓶配制此溶液 | |
| C. | 在转移操作中不慎将溶液洒到容量瓶外面,应该重新配制溶液 | |
| D. | 加蒸馏水至离刻度线1-2 cm时改用胶头滴管定容 |
11.四氯化碳按官能团分类应该属于( )
| A. | 烷烃 | B. | 烯烃 | C. | 卤代烃 | D. | 炔烃 |
1.下列有关问题,与盐的水解有关的是( )
①配制硫酸铜溶液时加入少量硫酸
②铝盐和铁盐可作净水剂
③MgCl2溶液蒸干后灼烧得到MgO
④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞.
①配制硫酸铜溶液时加入少量硫酸
②铝盐和铁盐可作净水剂
③MgCl2溶液蒸干后灼烧得到MgO
④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞.
| A. | ①②③ | B. | ②③④ | C. | ①④ | D. | ①②③④ |
5.下列叙述正确的是( )
| A. | 在同温同压下,甲容器中的氧气(O2)和乙容器中的氨气(NH3)所含的原子个数相同,则甲、乙两容器中气体的体积之比为1:2 | |
| B. | 任何条件下,等物质的量的甲烷(CH4)和一氧化碳所含的原子数一定相等 | |
| C. | 在标准状况时,20ml NH3与60ml N2所含的原子个数比为1:3 | |
| D. | 同温同压下,1L一氧化碳气体一定比1L氧气的质量小 |
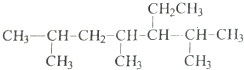 的系统命名是2,4,6-三甲基-3-乙基庚烷.
的系统命名是2,4,6-三甲基-3-乙基庚烷.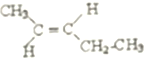 .
.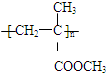 它的链节为
它的链节为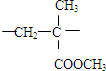 ,设其平均聚合度为3000,则该高聚物得平均相对分子质量为300 000.从结构角度看它应该属于线 型高分子.试推测有机玻璃能溶于CHCl3,具有热塑(填“热塑”或“固热”)性.
,设其平均聚合度为3000,则该高聚物得平均相对分子质量为300 000.从结构角度看它应该属于线 型高分子.试推测有机玻璃能溶于CHCl3,具有热塑(填“热塑”或“固热”)性.