题目内容
15.已知1-18号元素的离子aAm+、bBn+、cCp-、dDq-都具有相同的电子层结构,下列关系正确的是( )| A. | 若p>q,则还原性cCp-<dDq- | |
| B. | 若m>n,则碱性A(OH)m>B(OH)n | |
| C. | 若半径aAm+>bBn+,则a<b | |
| D. | 若半径aAm+>bBn+,则A的单质一定能从含Bn+的盐溶液中置换出B |
分析 短周期元素的离子:aAm+、bBn+、cCp-、dDq-均具有相同的电子层结构,则有:a-m=b-n=c+p=d+q,则有A、B在周期表中C、D的下一周期,且A、B为金属元素,C、D为非金属元素,且阳离子带有的电荷越多,其原子序数越大,阴离子带有的电荷越多,其原子序数越小,结合元素周期律递变规律解答该题.
解答 解:短周期元素的离子:aAm+、bBn+、cCp-、dDq-均具有相同的电子层结构,则有:a-m=b-n=c+p=d+q,则有A、B在周期表中C、D的下一周期,且A、B为金属元素,C、D为非金属元素,同周期:阳离子带有的电荷越多,其原子序数越大,阴离子带有的电荷越多,其原子序数越小,
A.阴离子带有的电荷越多,其原子序数越小,若p>q,则原子序数C<D,同周期随着原子序数的增大,其阴离子的还原性减弱,所以还原性cCp->dDq-,故A错误;
B.阳离子带有的电荷越多,其原子序数越大,若m>n,则原子序数A>B,同周期随着原子序数的增大,其最高价氧化物的水化物的碱性减弱,则碱性A(OH)m<B(OH)n,故B错误;
C.同周期阳离子的半径,随原子序数增大而减小,若半径aAm+>bBn+,则a<b,故C正确;
D.若A为活泼性很强的金属如Na,则不能从溶液中置换金属,因为Na与水能反应生成氢气,故D错误.
故选C.
点评 本题考查位置结构性质的相互关系及应用,明确核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.(1)在生活中,食物的选择与其酸碱性关系很大.其中蛋白质属于酸性食物,西红柿属于碱性食物.
(2)有四种常见药物①阿司匹林、②青霉素、③胃舒平、④麻黄碱. 某同学胃酸过多,应该服用③(填序号,下同);从用药安全角度考虑,使用前要进行皮肤敏感性测试的是②;由于具有兴奋作用,国际奥委会严禁运动员服用的是④.
(3)全世界每年因钢铁锈蚀造成大量的损失.某学生欲探究在蒸馏水、氯化钠溶液和醋酸溶液三种条件下铁锈蚀的快慢,设计了如下实验.
请回答
ⅰ在一周的观察过程中,他发现实验序号为①的试管中铁钉锈蚀速度最慢.
ⅱ实验②中发生的是电化学腐蚀(填“电化学腐蚀”或“化学腐蚀”).
ⅲ下列防止钢铁锈蚀的措施不合理的是B(填字母).
A.在自行车的钢圈表面镀上耐腐蚀的铬
B.在地下钢铁管道上连接铜块
C.改变金属内部结构制成不锈钢.
(2)有四种常见药物①阿司匹林、②青霉素、③胃舒平、④麻黄碱. 某同学胃酸过多,应该服用③(填序号,下同);从用药安全角度考虑,使用前要进行皮肤敏感性测试的是②;由于具有兴奋作用,国际奥委会严禁运动员服用的是④.
(3)全世界每年因钢铁锈蚀造成大量的损失.某学生欲探究在蒸馏水、氯化钠溶液和醋酸溶液三种条件下铁锈蚀的快慢,设计了如下实验.
| 实验序号 | ① | ② | ③ |
| 实验 内容 |  |  |  |
ⅰ在一周的观察过程中,他发现实验序号为①的试管中铁钉锈蚀速度最慢.
ⅱ实验②中发生的是电化学腐蚀(填“电化学腐蚀”或“化学腐蚀”).
ⅲ下列防止钢铁锈蚀的措施不合理的是B(填字母).
A.在自行车的钢圈表面镀上耐腐蚀的铬
B.在地下钢铁管道上连接铜块
C.改变金属内部结构制成不锈钢.
6.下列推断正确的是( )
| A. | 共价键只有方向性 | |
| B. | 离子晶体中只存在阴阳离子间的静电吸引力 | |
| C. | Na2O2中阴阳离子个数比为1:2 | |
| D. | 化学式CO2、SiO2、NaCl、CaH2都可以表示分子 |
20.某一反应物的浓度是1.0mol/L,经过10s后,它的浓度变成了0.2mol/L,在这10s内,它的反应速率为( )
| A. | 0.08mol/L | B. | 0.08mol/(L•s) | C. | 0.04mol/(L•min) | D. | 0.04 mol/(L•s) |
4.水中的HgCl2在微生物作用下,能产生毒性更大的有机物:
HgCl2+CH4$\stackrel{微生物}{→}$CH3HgCl+HCl ①水中的NH3在微生物作用下发生如下变化:2NH3+3O2$\stackrel{微生物}{→}$2HNO2+2H2O ②2HNO2+O2$\stackrel{微生物}{→}$2HNO3 ③
下列说法不正确的是 ( )
HgCl2+CH4$\stackrel{微生物}{→}$CH3HgCl+HCl ①水中的NH3在微生物作用下发生如下变化:2NH3+3O2$\stackrel{微生物}{→}$2HNO2+2H2O ②2HNO2+O2$\stackrel{微生物}{→}$2HNO3 ③
下列说法不正确的是 ( )
| A. | 反应①是取代反应,反应②③是氧化还原反应 | |
| B. | 水中溶解的NH3会导致水生动物死亡 | |
| C. | 向氨超标的河水中加稀硫酸是一种行之有效的处理方法 | |
| D. | 自来水中的HgCl2可加入Na2S处理 |
 汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源.
汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源. 2NO;汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因温度升高,反应速率加快.
2NO;汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因温度升高,反应速率加快.
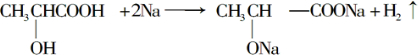 ;
; ;
;