题目内容
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素:
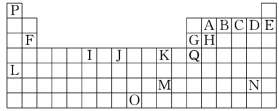
(1)I的最高化合价为________,K的元素名称为________。
(2)基态时Q元素原子的电子排布式_________________________________,J元素原子的外围电子排布式______________________。
(3)下列对比正确的是________。
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是________。
a.L位于元素周期表中第5周期ⅠA族,属于s区元素
b.O位于元素周期表中第7周期ⅧB族,属于d区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
(5)由P、A、C三种元素形成的某化合物,对氢气的相对密度为15,则该分子的键角约为________。
(6)元素B和C的气态氢化物热稳定性较强的是________(填化学式)。
(7)K的常见离子和B的最简单氢化物形成的配离子的名称为________,其水溶液颜色为________。Ag和元素K同族,且在K的下一周期,则Ag元素的原子序数为________,Ag也可以和B的最简单氢化物形成配离子,配位数为2,该配离子的符号为________。
【答案】+6 铜 1s22s22p63s23p63d104s24p1 3d64s2 cd bc 120° H2O 四氨合铜离子 深蓝色 47 [Ag(NH3)2]+
【解析】
由元素在周期表中位置,可知P为H、A为C、B为N、C为O、D为F、E为Ne、F为Mg、G为Al、H为Si、I为Cr、J为Fe、K为Cu、Q为Ga、L为Rb、N为At,结合元素的结构与性质解答。
(1)I为Cr,价电子排布式为3d54s1,最高正化合价为+6,K为Cu元素,元素名称为铜;
(2)Q为Ga,31号元素,基态时Q元素原子的电子排布式1s22s22p63s23p63d104s24p1;J为Fe,原子核外有26个电子,核外电子排布式为1s22s22p63s23p63d64s2,原子的外围电子排布式3d64s2;
(3)a.A为C、B为N、G为Al、H为Si,同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径G>H>A>B,故a错误;
b.B为N、C为O、D为F、E为Ne,同周期自左而右第一电离能呈增大趋势,但IIA族、VA元素的第一电离能高于同周期相邻元素的,故第一电离能E>D>B>C,故b错误;
c.A为C、G为Al、H为Si、Q为Ga,同周期自左而右电负性增大、同主族自上而下电负性减小,故电负性A>H>G>Q,故c正确;
d.A为C、B为N、G为Al、H为Si,非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性B>A>H>G,则最高价氧化物的水化物酸性B>A>H>G,故d正确;
答案选cd;
(4)a.由L的位置可知,L位于元素周期表中第五周期ⅠA族,属于s区元素,故a正确;
b.由O的位置可知,O位于元素周期表中第七周期Ⅷ族,属于d区元素,故b错误;
c.M位于IB族,外围电子排布式为5d106s1,属于ds区元素,故c错误;
d.H处于IVA族,所在族的外围电子排布式为ns2np2,属于p区元素,故d正确;
答案选bc;
(5)由H、C、O三种元素形成的某化合物,对氢气的相对密度为15,则该化合物相对分子质量为30,故该化合物为HCHO,为平面三角形,键角约是120°;
(6)B为N、C为O,其气态氢化物NH3和H2O,非金属性越强,其简单气态氢化物的稳定性越强,非金属性O>N,故氢化物稳定性:H2O>NH3;
(7)K的常见离子为Cu2+、B的最简单氢化物为NH3,二者形成的[Cu(NH3)4]2+配离子,名称为四氨合铜离子,其水溶液呈深蓝色,Ag和元素K同族,且在K的下一周期,二者原子序数相差为第四周期容纳元素种数,故Ag的原子序数为29+18=47;Ag+也可以和NH3形成配离子,配位数为2,该配离子为[Ag(NH3)2]+。

【题目】CO2与CH4可制得合成气:CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+247 kJ·mol-1。初始温度均为T K时,在3个容器中按不同方式投入反应物,发生上述反应,相关信息如下表:
容器 | 起始物质的量/mol | CO2平衡转化率(α) | |||||
编号 | 容积/L | 条件 | CH4(g) | CO2(g) | CO(g) | H2(g) | |
Ⅰ | 2 | 恒温恒容 | 2 | 1 | 0 | 0 | 50% |
Ⅱ | 1 | 0.5 | 1 | 0 | 0 | ||
Ⅲ | 1 | 绝热恒容 | 1 | 0.5 | 0 | 0 | - |
下列说法正确的是
A.T K时,反应CH4(g)+CO2(g)2CO(g)+2H2(g)的平衡常数为1/3
B.容器Ⅱ中反应达到平衡时,α(CO2,Ⅱ)=50%
C.容器Ⅲ中反应达到平衡时反应热在123.5—247 kJ·mol-1范围内
D.容器Ⅱ中反应达到平衡时,再投入0.5 mol CH4、0.25 mol CO,反应达到新平衡前,v(正)<v(逆)