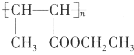题目内容
【题目】氮、磷、砷、铁等元素及其化合物在现代农业、科技、国防建设中有着许多独特的用途。
(1)基态砷原子中核外电子占据最高能层的符号为__,该能层的原子轨道数有__个。
(2)氮的一种氢化物N2H4是一种良好的火箭发射燃料,传统制备肼的方法是:NaClO+2NH3=N2H4+NaCl+H2O,又知肼的熔点、沸点分别为1.4℃、113.5℃,氨气的熔点、沸点分别为-77.7℃、-33.5℃。
①N2H4中氮原子的杂化轨道类型为__杂化,基态N原子电子占据最高能级的电子云轮廓图为___形。
②肼与氨气熔点、沸点差异最主要的原因是__。
(3)氨分子是一种常见配体,配离子[Co(NH3)6]3+中存在的化学键有__(填序号)。
A.离子键 B.极性键 C.配位键 D.氢键
【答案】N 16 sp3 哑铃型 N2H4分子间氢键数目多于NH3分子间氢键数目 BC
【解析】
砷位于周期表中第4周期第ⅤA族;根据核外电子的排布式判断最高能层和该能层具有的轨道数;根据价层电子对互斥理论判断N2H4的杂化类型;分子间含有氢键多的沸点较高;配离子[Co(NH3)6]3+中存在的化学键有配位键,配体NH3中含有极性共价键,然后分析。
(1)砷位于周期表中第4周期第ⅤA族,基态As核外电子占据最高能层为N,N能层具有s、p、d、f四个能级,s上有1个轨道,p上有3个轨道,d上有5个原子轨道,f上有7个原子轨道,所以共有16个原子轨道;
(2) ①肼的电子式为: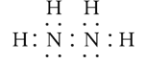 ,N2H4中N原子含有3对成键电子对和1对孤电子对,则价层电子对数为4,所以氮原子杂化轨道类型为sp3杂化,基态N原子的核外电子排布式为:1s22s22p3,电子占据最高能级为2p能级,电子云轮廓图为哑铃型;
,N2H4中N原子含有3对成键电子对和1对孤电子对,则价层电子对数为4,所以氮原子杂化轨道类型为sp3杂化,基态N原子的核外电子排布式为:1s22s22p3,电子占据最高能级为2p能级,电子云轮廓图为哑铃型;
②N2H4分子间氢键数目多于NH3分子间氢键数目,导致肼与氨气熔点、沸点差异较大;
(3)配离子[Co(NH3)6]3+中存在氨分子和钴离子之间的配位键,配体NH3中存在极性共价键,配离子[Co(NH3)6]3+中存在的化学键有极性键和配位键,答案选BC。

 阅读快车系列答案
阅读快车系列答案【题目】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题。
Ⅰ.已知H—H键的键能为a kJ·mol-1,N—H键的键能为bkJ·mol-1,N![]() N键的键能是ckJ·mol-1,则反应NH3(g)
N键的键能是ckJ·mol-1,则反应NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的ΔH=____kJ·mol-1,若在某温度下其平衡常数为K,则N2(g)+3H2(g)
H2(g)的ΔH=____kJ·mol-1,若在某温度下其平衡常数为K,则N2(g)+3H2(g)![]() 2NH3(g)的平衡常数K1=____(用K表示)。
2NH3(g)的平衡常数K1=____(用K表示)。
Ⅱ.一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3)是常用的饮用水二级消毒剂。
(1)用Cl2和NH3反应制备三氯胺的方程式为3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
甲(400℃)n(Cl2)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(T℃)n(Cl2)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃___400℃(填“>”或“<”),该反应的ΔH___0(填“>”或“<”)。
②该反应自发行的条件是____(填高温、低温、任何温度)。
③对该反应,下列说法正确的是___(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C.反应达平衡后,其他条件不变,加入一定量的NCl3,平衡将向逆反应方向移动
D.反应达到平衡后,其他条件不变,在原容器中按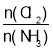 =1继续充入一定量反应物,达新平衡后Cl2的转化率增大
=1继续充入一定量反应物,达新平衡后Cl2的转化率增大
(2)工业上可利用反应2Cl2(g)+NH3(g)![]() NHCl2 (l)+2HCl(g)制备二氯胺。
NHCl2 (l)+2HCl(g)制备二氯胺。
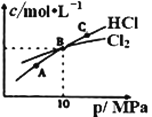
①NHCl2在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出该反应的化学方程式____。
②在恒温条件下,将2molCl2和1molNH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是___点(填“A”“B”或“C”);B点时反应物转化率:α(Cl2)___α(NH3)(填“>”“=”或“<”),若B点平衡体积为2L,则平衡常数K=____。