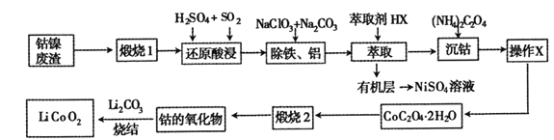
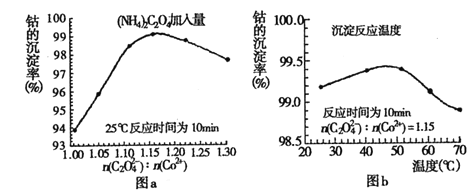
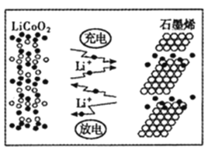
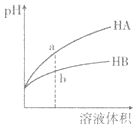
题目内容
【题目】工业上以食盐、氨气、二氧化碳等物质为原料制取纯碱。
(1)实验室提纯粗盐的一个重要环节是除去粗盐水中的杂质阳离子(主要含Ca2+、Mg2+),提纯该粗盐时,可考虑在粗盐水中依次加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。A____ 、B_____。
(2)氨气分子的空间构型为_____,其中N原子采用_____杂化方式,二氧化碳中心原子C采用_____杂化方式。
(3)上述实验涉及的元素中,Ca基态原子电子排布式为__________________。
(4)上述实验涉及的元素中,O2-、Na+、Cl-中半径最小的是__________。
(5)制取纯碱时,向饱和食盐水中通入气体,即可得到小苏打的沉淀物,氨气与二氧化碳通入的先后顺序是:_________,因为:___________
(6)写成工业上以食盐、氨气、二氧化碳等物质为原料制取小苏打反应的化学方程式:______
【答案】Ca(OH)2或CaO Na2CO3 三角锥形 sp3 sp 1s22s22p63s23p64s2 Na+ 先通入氨气后通入二氧化碳 氨气的溶解度较大,且生成的氨水呈碱性,有利于二氧化碳的吸收 NaCl+NH3+H2O+CO2 = NaHCO3↓+NH4Cl
【解析】
(1)要除去粗盐水中的杂质阳离子Ca2+、Mg2+,可在粗盐水中加入沉淀剂Ca(OH)2或CaO(CaO与水反应生成Ca(OH)2,所以实际起作用的还是Ca(OH)2)。将镁离子转化为氢氧化镁沉淀、加入Na2CO3将钙离子转化为碳酸钙沉淀,所以A为Ca(OH)2或CaO、B为Na2CO3;
(2)NH3分子中N原子的价电子对数为![]() ,含有一对孤对电子,分子的空间构型为三角锥形,N原子采用sp3杂化,CO2分子中C原子的价电子对数为
,含有一对孤对电子,分子的空间构型为三角锥形,N原子采用sp3杂化,CO2分子中C原子的价电子对数为![]() ,C原子采用sp杂化;
,C原子采用sp杂化;
(3)Ca的基态原子核外有20个电子,根据核外电子排布规律可得Ca基态原子的电子排布式为1s22s22p63s23p64s2;
(4)Cl-的核外有3个电子层,Na+和O2-的核外均为2个电子层,电子层数越多,半径越大,电子层数相同时,核电荷数越大,半径越小,则Na+半径最小;
(5)由于氨气的溶解度较大,氨气与水生成的氨水呈碱性,有利于二氧化碳的吸收,因此制取纯碱时,向饱和食盐水中先通入氨气后通入二氧化碳,即可得到小苏打的沉淀物;
(6)工业上制取小苏打(NaHCO3)时,以食盐(NaCl)、氨气和CO2与H2O反应生成NaHCO3和NH4Cl,反应的化学方程式为:NaCl+NH3+H2O+CO2 =NaHCO3↓+NH4Cl。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案