��Ŀ����
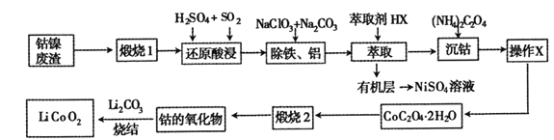
����Ŀ������������(��Ҫ�ɷ�ΪCo2O3��NiS����������Ԫ�صĻ����������)����ȡ�Ʊ�����ӵ�صĵ缫����LiCoO2�Ĺ������£�
��֪��CoC2O4 2H2O ����ˮ�������ܽ�����¶����߶������������������![]() ��������
��������![]() ���ܽ⡣
���ܽ⡣
(1) ������1������ҪĿ����________________��
(2) ����ԭ�����������Co2O3������Ӧ�����ӷ���ʽΪ ______________��
(3) ���������������̵������Լ������÷ֱ���______________________��
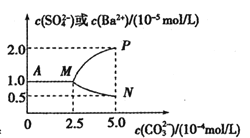
(4)�������������У�(NH4)2C2O4�ļ�����(ͼa)��������Ӧ���¶�(ͼb)���ܵij����ʹ�ϵ��ͼ��ʾ��
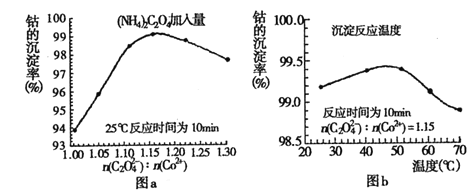
����n(![]() ):n(Co2+) ��ֵ�����ӣ��ܵij���������С��ԭ����__________��
):n(Co2+) ��ֵ�����ӣ��ܵij���������С��ԭ����__________��
�ڳ�����Ӧʱ��Ϊ10min�����¶ȸ���50������ʱ���ܵij������½���ԭ�������_______��
(5)Ϊ�˻�ý�Ϊ������CoC2O42H2O��������X����ʵ�����Ϊ_______________��
(6)��֪����CoC2O42H2Oʱ�¶Ȳ�ͬ�����ﲻͬ��400��ʱ�ڿ����г�����գ��õ��ܵ�����������Ϊ2.41g��CO2�����Ϊ1.344L(��״����)�����ʱ�����ܵ�������Ļ�ѧʽΪ____________ ��
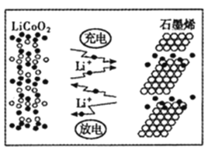
(7)�������������ʯīϩ����͵缫֮����ٴ��������˶������ԣ�������ʯīϩ��أ���ط�ӦʽΪLixC6+Li1-xCoO2![]() C6+ LiCoO2���乤��ԭ����ͼ������ʱLiCoO2�ĵ缫��ӦʽΪ__________________��
C6+ LiCoO2���乤��ԭ����ͼ������ʱLiCoO2�ĵ缫��ӦʽΪ__________________��
���𰸡�ʹԭ�ϳ��������ʹ���ʷֽ⣬�ų��ӷ��ɷ֣��ı�ṹ���ڷۻ� Co2O3+SO2+2H+=2Co2++![]() +H2O ��Fe2+����ΪFe3+������pH���ٽ�ˮ�⣬ʹ��Һ��Fe3+��Al3+���ɳ�����ȥ ������
+H2O ��Fe2+����ΪFe3+������pH���ٽ�ˮ�⣬ʹ��Һ��Fe3+��Al3+���ɳ�����ȥ ������![]() ��Co2+ ��Ӧ����
��Co2+ ��Ӧ����![]() ���ܽ� CoC2O4���ܽ�����¶����߶������� ���ˡ�ϴ�ӡ����� Co3O4 LiCoO2-xe- = xLi++Li1-xCoO2
���ܽ� CoC2O4���ܽ�����¶����߶������� ���ˡ�ϴ�ӡ����� Co3O4 LiCoO2-xe- = xLi++Li1-xCoO2
��������
��������(��Ҫ�ɷ�ΪCo2O3��NiS����������Ԫ�صĻ����������)���գ�NiSת��Ϊ����������Ͷ���������������Ԫ�صĻ�����Ҳת��Ϊ�����Ȼ����ϡ����Ͷ�������ԭ�������Co3+��ԭΪCo2+�����˺���Һ�м���NaClO3��NaClO3��Fe2+����ΪFe3+������̼���Ƶ�����ҺpH��ʹ��Һ��Fe3+��Al3+������������ȡ����ȡ��ȥ�����ӣ�Ȼ���ټ������什�Co2+ת��ΪCoC2O4 2H2O�������ϴ�ӵõ�CoC2O4 2H2O���壻��CoC2O4 2H2O���յõ��ܵ����������Li2CO3�ս�õ�LiCoO2���ݴ˷������(1)��(6)��
(7)���ݵ�ط�ӦʽLixC6+Li1-xCoO2![]() C6+ LiCoO2֪�����ʱLiCoO2��������������ʧ���ӵ�������Ӧ����Li1-xCoO2���ݴ���д�缫��Ӧʽ��
C6+ LiCoO2֪�����ʱLiCoO2��������������ʧ���ӵ�������Ӧ����Li1-xCoO2���ݴ���д�缫��Ӧʽ��
(1) ������1�����ܹ���ԭ�ϳ����������ʹ���ʷֽ⣬�ų��ӷ��ɷ֣�ͬʱ�ı����������ṹ�����ڷۻ����ʴ�Ϊ��ʹԭ�ϳ��������ʹ���ʷֽ⣬�ų��ӷ��ɷ֣��ı�ṹ���ڷۻ���
(2) ����ԭ�����������Co2O3�ܹ�������������������Ӧ�����ӷ���ʽΪCo2O3+SO2+2H+=2Co2++![]() +H2O���ʴ�Ϊ��Co2O3+SO2+2H+=2Co2++
+H2O���ʴ�Ϊ��Co2O3+SO2+2H+=2Co2++![]() +H2O��
+H2O��
(3)��ԭ�������NaClO3��Na2CO3��NaClO3��Fe2+����ΪFe3+��̼���Ƶ�����ҺpH��ʹ��Һ��Fe3+��Al3+�������ʴ�Ϊ����Fe2+����ΪFe3+������pH���ٽ�ˮ�⣬ʹ��Һ��Fe3+��Al3+���ɳ�����ȥ��
(4)����Һ�д��ڻ�ѧƽ�⣺![]() (aq)+Co2+(aq)+2H2O(l)CoC2O42H2O(s)����n(
(aq)+Co2+(aq)+2H2O(l)CoC2O42H2O(s)����n(![]() )��n(Co2+)��ֵ�����ӣ�c(
)��n(Co2+)��ֵ�����ӣ�c(![]() )����ѧƽ��������У������ھ������������ﵽn(
)����ѧƽ��������У������ھ������������ﵽn(![]() )��n(Co2+)=1.15�Ժ��������������࣬�ᷢ������ӦCoC2O42H2O+(n-1)
)��n(Co2+)=1.15�Ժ��������������࣬�ᷢ������ӦCoC2O42H2O+(n-1)![]() =
=![]() ��ʹ���岿���ܽ⣬�ʴ�Ϊ��������
��ʹ���岿���ܽ⣬�ʴ�Ϊ��������![]() ��Co2+��Ӧ����
��Co2+��Ӧ����![]() ���ܽ⣻
���ܽ⣻
�ڳ�����Ӧʱ��Ϊ10min�����¶ȸ���50������ʱ�����¶����߶��ܵij��������ߵĿ���ԭ���������ܽ�����¶����߶������ʴ�Ϊ��CoC2O4���ܽ�����¶����߶�������
(5)�������麟�������CoC2O4 2H2O��CoC2O4 2H2O ����ˮ��Ϊ�˻�ý�Ϊ������CoC2O42H2O��������X��Ϊ���ˡ�ϴ�ӡ�����ʴ�Ϊ�����ˡ�ϴ�ӡ����
(6)n(CO2)=![]() =0.06mol������Cԭ���غ��n(CoC2O4)=0.03mol�����ɵ���������n(Co)=0.03mol��n(O)=
=0.06mol������Cԭ���غ��n(CoC2O4)=0.03mol�����ɵ���������n(Co)=0.03mol��n(O)=![]() =0.04mol����n(Co)��n(O)=0.03mol��0.04mol=3��4��������������Ļ�ѧʽΪCo3O4���ʴ�Ϊ��Co3O4��
=0.04mol����n(Co)��n(O)=0.03mol��0.04mol=3��4��������������Ļ�ѧʽΪCo3O4���ʴ�Ϊ��Co3O4��
(7) ���ݵ�ط�ӦʽΪLixC6+Li1-xCoO2![]() C6+ LiCoO2�����ʱ��LiCoO2��������������ʧ���ӵ�������Ӧ�������ĵ缫��ӦΪ��LiCoO2-xe- = xLi++Li1-xCoO2���ʴ�Ϊ��LiCoO2-xe-= xLi++Li1-xCoO2��
C6+ LiCoO2�����ʱ��LiCoO2��������������ʧ���ӵ�������Ӧ�������ĵ缫��ӦΪ��LiCoO2-xe- = xLi++Li1-xCoO2���ʴ�Ϊ��LiCoO2-xe-= xLi++Li1-xCoO2��

 ��������ϵ�д�
��������ϵ�д�����Ŀ������ѡ���е�ԭ������������Ӧ���ǣ� ��
ѡ�� | ���� | ԭ������ |
A | ��H2O2�м���MnO2���ܼ���H2O2�ķֽ����� | MnO2�����˷�Ӧ����Ļ�� |
B | ��5mL 0.005mol��L-1FeCl3��Һ�м���5mL0.010mol��L-1KSCN��Һ����Һ�ʺ�ɫ���ٵμ�1ml1 mol��L-1KCl��Һ����Һ��ɫ��dz | ����������Ũ�ȣ�ƽ�����淴Ӧ�����ƶ� |
C | ��ʢ��NO2������ܱ�������������ˮ�У�������������ɫ���� | 2NO2��g�� |
D | ���ܱ��������з�Ӧ��A+xB��g�� | ��AΪ���塢x>1 |
A.AB.BC.CD.D
����Ŀ��ijУ��ѧ�о�С����Զ�У���������������вⶨ��ش��������⡣
(1)����ͬѧ�������ͼ��ʾ��ʵ��װ�ã��Կ�����SO2�����������ﺬ�����вⶨ������װ�����ӵ�˳��Ϊ(����� )________________��

ע���������ٹ�������������λʱ����ͨ������������װ��
��������װ�ö����ⶨ�����е�SO2�Ϳ���������ĺ��������ⶨ��������(��λ��cm3��min-1)���Ҫ�ⶨ____________��____________��
����֪���ⵥ������ˮ��KI�����������ˮ�е��ܽ�ȡ�����Э������ͬѧ���100mL 5��10-4mo1 L-1����Һ�����ƣ�
��һ�����õ�����ƽȷ��ȡ1.27g�ⵥ�ʼ����ձ��У�______________��
�ڶ���������һ��������Һ��ϴ��Һȫ��ת��_____ mL������ƿ�У���ˮ���ݣ�ҡ�ȡ�
���������ӵڶ���������Һ��ȡ��10.00mL��Һ����100mL����ƿ�У���ˮϡ�����̶��ߣ�ҡ�ȡ�
(2)����ͬѧ������ͼ����װ�òⶨ�����е�SO2������

�ټ���װ�õ�������ʱ�������Թ���װ��������ˮ(��֤�����ܵ��¶˽�û��ˮ��)��Ȼ��__________(��д��������)ʱ�����ῴ��_____________(��дʵ������)����֤����װ�õ����������á�
�ڲⶨָ���ص�����е�SO2����ȷ��ȡ1.00mL 5��10-4mo1L-1����Һ��ע����ͼ��ʾ�Թ��С�������������ˮ�N�ͺ��ټ�2~3�ε�����Һ�����Ƴ���ҺA���ס�������ͬѧ�ֱ�ʹ����ͼ��ʾ��ͬ��ʵ��װ�ú���ҺA����ͬһ�ص㡢ͬʱ����ע�����Ļ���������������ֱ����Һ����ɫȫ���ʾ�Ϊֹֹͣ��������¼������������(����ÿ�γ���500mL)��
���� | ���� | ���� |
�������� | 110 | 145 |
�ҹ����������������Կ��������ⶨ��SO2�����Ũ����ֵ���±���
���Ũ����ֵ/mg��m-3 | ||
һ���� | ������ | ������ |
0.15 | 0.50 | 0. 70 |
����ʦ��ͬѧ�Ƿ������жϼ���ⶨ�����Ϊȷ����õص�Ŀ�����SO2 �ĺ���Ϊ_______mgm-3(����2 λ��Ч����)������________(���)�����������������ʵ���������ϴ�ƫ���ԭ����(����С������װ�ú�ҩƷ��������)______________��