题目内容
11.有以下四种说法中错误的组合编号为 ( )①溶液的酸性越强,水的电离度就越小
②升高温度,弱酸、弱碱溶液中的c(H+)、c(0H-)一定增大
③强酸溶液的酸性-定强于弱酸溶液的酸性
④因为c(H+)=c•α,所以在一定温度下稀释某一元弱酸时,c(H+)与α成正比.
| A. | ①③ | B. | ②④ | C. | ①③④ | D. | ②③④ |
分析 ①对于强碱弱酸盐溶液,促进水的电离,酸性越强,水的电离度越大;
②升温促进弱酸、弱碱的电离,使弱酸酸性增强,减小减弱;
③溶液酸性强弱决定于氢离子浓度的大小;
④对弱酸加水稀释,弱酸电离程度增强,但溶液酸性减弱.
解答 解:①对于强碱弱酸盐溶液,促进水的电离,酸性越强,水的电离度越大,故错误;
②升温,弱酸溶液中氢离子浓度增大,氢氧根离子浓度减小,弱碱溶液中氢氧根离子浓度增大,氢离子浓度减小,故错误;
③强酸溶液中氢离子浓度小于弱酸溶液中氢离子浓度时,弱酸的酸性强,故错误;
④对弱酸加水稀释,c(H+)与α成反比,故错误;
故选D.
点评 本题考查了强弱电解质的区别以及对其他物质的影响,注意弱电解质的离子浓度不一定小,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
1.工业上制备相关物质,涉及的反应原理及部分流程较为合理的是( )
| A. | 制取镁:海水$\stackrel{Ca(OH)_{2}}{→}$Mg(OH)2$\stackrel{高温}{→}$MgO$\stackrel{点燃}{→}$Mg | |
| B. | 冶炼铝:铝土矿$\stackrel{过量NaOH(aq)}{→}$NaAlO2$\stackrel{过量HCl(aq)}{→}$无水AlCl3$\stackrel{电解}{→}$Al | |
| C. | 制溴:浓缩海水$\stackrel{Cl_{2}}{→}$Br2$→_{海水}^{空气}$$\stackrel{SO_{2}吸收}{→}$HBr(aq)$→_{(2)再进一步操作}^{(1)Cl_{2}}$Br2 | |
| D. | 制碘:海带$\stackrel{O_{2+}灼烧}{→}$海带灰$\stackrel{H_{2}O浸取}{→}$$\stackrel{Cl_{2}}{→}$I2(aq)$→_{(2)再进一步操作}^{(1)热裂汽油,萃取}$I2 |
2.NA表示阿伏加德罗常数的值,以下说法正确的是( )
| A. | 1 L CO的质量小于1 L O2的质量 | |
| B. | 常温下9 g H2O中所含原子数为1.5NA | |
| C. | 标准状况下,1mol任何物质体积均为22.4L | |
| D. | OH-的摩尔质量为17 g |
19.下列说法正确的是( )
| A. | 石油干馏可得到汽油、煤油等 | |
| B. | 破坏乙烯分子里C=C键所需吸收的能量是破坏乙烷分子里C-C键能量的两倍 | |
| C. | 油脂不是高分子化合物,1mol油脂完全皂化生成1mol甘油和3 mol高级脂肪酸 | |
| D. |  和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物 ,该反应符合绿色化学的原则 ,该反应符合绿色化学的原则 |
3.表给出了六种元素的相关信息,其中A、B、C、D、E为短周期元素.
请根据以上信息回答问题:
(1)A元素符号H,F元素的名称铁;
(2)C元素在周期表中的位置第2周期VA族;
(3)B和D对应的气态氢化物中,稳定性强的是H2O,熔沸点高的是H2O;(用具体的化学式回答)
(4)D的最高价含氧酸稀溶液与F单质反应的离子方程式:Fe+2H+=Fe2++H2↑;
(5)E单质燃烧生成的淡黄色固态化合物与CO2反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
| 元素 | 相 关 信 息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料. |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障. |
| C | 植物生长三种必需元素之一,它能形成多种氧化物,其氢化物是中学化学里学习的唯一的碱性气体,能使湿润的红色石蕊试纸变蓝. |
| D | 室温下其单质呈淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
| E | 它在空气剧烈燃烧,有黄色火焰,生成的淡黄色固态化合物可用于潜水艇的供氧剂. |
| F | 它是人体不可缺少的微量元素,其单质也是应用最广的金属原材料,常用于制造桥梁、轨道等. |
(1)A元素符号H,F元素的名称铁;
(2)C元素在周期表中的位置第2周期VA族;
(3)B和D对应的气态氢化物中,稳定性强的是H2O,熔沸点高的是H2O;(用具体的化学式回答)
(4)D的最高价含氧酸稀溶液与F单质反应的离子方程式:Fe+2H+=Fe2++H2↑;
(5)E单质燃烧生成的淡黄色固态化合物与CO2反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
1.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 在常温常压下,11.2 L N2含有的原子数为NA | |
| B. | 32 g O2在标准状况下所占体积约为22.4 L | |
| C. | 标准状况下,18 g H2O所占的体积约为22.4 L | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相同 |
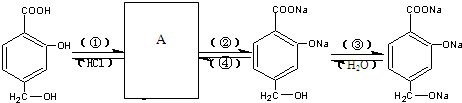
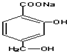 .
.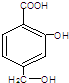 +NaHCO3→
+NaHCO3→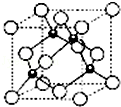 原子序数依次增大的五种元素A、B、C、D、E,其中A是周期表中原子半径最小元素,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E的原子序数为29.回答下列问题(所有元素均用元素符号表示):
原子序数依次增大的五种元素A、B、C、D、E,其中A是周期表中原子半径最小元素,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E的原子序数为29.回答下列问题(所有元素均用元素符号表示):