题目内容
2.NA表示阿伏加德罗常数的值,以下说法正确的是( )| A. | 1 L CO的质量小于1 L O2的质量 | |
| B. | 常温下9 g H2O中所含原子数为1.5NA | |
| C. | 标准状况下,1mol任何物质体积均为22.4L | |
| D. | OH-的摩尔质量为17 g |
分析 A.两种气体状况为知;
B.质量转化为物质的量,1个水分子含有3个原子;
C.气体摩尔体积只适应与气体;
D.摩尔质量单位为g/mol.
解答 解:A.气体状况为知,无法计算二者物质的量,无法比较,故A错误;
B.9 g H2O含有水的物质的量为$\frac{9g}{18g/mol}$=0.5mol,含有原子个数为1.5NA,故B正确;
C.标准状况下,1mol任何气体体积均为22.4L,故C错误;
D.OH-的摩尔质量为17 g/mol,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数,熟练掌握阿伏伽德罗常数有关计算公式是解题关键,注意气体摩尔体积使用对象和条件,题目难度不大.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
10.NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA | |
| B. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA | |
| C. | 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
17.已知M为质量数为27,中子数为14的元素形成的单质,则下列物质不能与M反应的是( )
| A. | AgNO3溶液 | B. | NaOH溶液 | C. | Fe3O4 | D. | MgO |
7.用如图所示装置分别进行如下实验,测定导电性变化,溶液导电能力明显增强的是( )
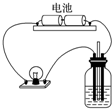

| A. | 向AgNO3溶液中通入少量HCl | B. | 向H2SO3溶液中通入Cl2 | ||
| C. | 向FeI2溶液中通入少量Cl2 | D. | 向NaOH溶液中通入少量Cl2 |
14.下列几种物质的保存方法中,不正确的是( )
| A. | 氯化铁溶液保存时加入少量的盐酸 | B. | 氯水保存在棕色瓶里并放在冷暗处 | ||
| C. | 漂白粉可以在敞口容器中长期存放 | D. | 溴水盛放在有玻璃塞的细口瓶中 |
11.有以下四种说法中错误的组合编号为 ( )
①溶液的酸性越强,水的电离度就越小
②升高温度,弱酸、弱碱溶液中的c(H+)、c(0H-)一定增大
③强酸溶液的酸性-定强于弱酸溶液的酸性
④因为c(H+)=c•α,所以在一定温度下稀释某一元弱酸时,c(H+)与α成正比.
①溶液的酸性越强,水的电离度就越小
②升高温度,弱酸、弱碱溶液中的c(H+)、c(0H-)一定增大
③强酸溶液的酸性-定强于弱酸溶液的酸性
④因为c(H+)=c•α,所以在一定温度下稀释某一元弱酸时,c(H+)与α成正比.
| A. | ①③ | B. | ②④ | C. | ①③④ | D. | ②③④ |
12.NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 常温常压下,O2和O3组成的混合气48g中所含氧原子数为3NA | |
| B. | 0.1mol•L-1硫酸溶液中含有H+个数为0.2 NA | |
| C. | 1molFe与足量盐酸反应,Fe失去电子数为3NA | |
| D. | 1.8g NH4+中含有的电子数为1.1 NA |
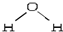 ,折线型结构,正负电荷的重心不能重合,因此为极性分子;CO2的结构式为 O═C═O,正负 电荷的重心重合,为非极性分子.又知极性分子易溶于极性分子中,而非极性分子易溶于非极性分子中,叫相似相溶原理.
,折线型结构,正负电荷的重心不能重合,因此为极性分子;CO2的结构式为 O═C═O,正负 电荷的重心重合,为非极性分子.又知极性分子易溶于极性分子中,而非极性分子易溶于非极性分子中,叫相似相溶原理.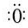 →
→ .
.