题目内容
20. 原子序数依次增大的五种元素A、B、C、D、E,其中A是周期表中原子半径最小元素,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E的原子序数为29.回答下列问题(所有元素均用元素符号表示):
原子序数依次增大的五种元素A、B、C、D、E,其中A是周期表中原子半径最小元素,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E的原子序数为29.回答下列问题(所有元素均用元素符号表示):(1)B2A2分子中B原子轨道的杂化类型为sp,
(2)B、C、D第一电离能由大到小为:N>O>C,E元素基态原子电子排布式为:[Ar]3d104s1.
(3)在天津爆炸事件中可能造成含B、C元素组成的钠盐的泄漏,该盐对应酸的结构式为H-C≡N.
(4)元素B、D形成的一种化合物与元素C、D形成的一种化合物互为等电子体,元素C、D形成化合物的分子式是N2O.
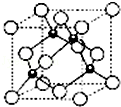
(5)元素E的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是CuCl,测得其晶胞边长为acm,则该晶体密度为$\frac{398}{{N}_{A}×{a}^{3}}$g/cm3.
分析 原子序数依次增大的五种元素A、B、C、D、E,其中A是周期表中原子半径最小元素,则A为H元素;B原子基态时最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;D原子基态时2p原子轨道上有2个未成对的电子,原子序数大于碳,故D核外电子排布为1s22s22p4,则D为O元素;C的原子序数介于碳、氧之间,故C为N元素;E的原子序数为29,则E为Cu元素,据此解答.
解答 解:原子序数依次增大的五种元素A、B、C、D、E,其中A是周期表中原子半径最小元素,则A为H元素;B原子基态时最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;D原子基态时2p原子轨道上有2个未成对的电子,原子序数大于碳,故D核外电子排布为1s22s22p4,则D为O元素;C的原子序数介于碳、氧之间,故C为N元素;E的原子序数为29,则E为Cu元素.
(1)C2H2分子结构式为H-C≡C-H,C原子形成2个σ键,没有孤对电子,故碳原子轨道的杂化类型为sp杂化,
故答案为:sp;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,但氮元素原子2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:N>O>C;
E的原子序数为29,则E为Cu元素,基态原子简化电子排布式为:[Ar]3d104s1,
故答案为:N>O>C;[Ar]3d104s1;
(3)在天津爆炸事件中可能造成含B、C元素组成的钠盐的泄漏,该盐为NaCN,对应酸的结构式为H-C≡N,
故答案为:H-C≡N;
(4)元素C、O形成的一种化合物与元素N、O形成的一种化合物互为等电子体,应是CO2与N2O,
故答案为:N2O;
(5)元素E的一种氯化物晶体的晶胞结构如图所示,晶胞中白色球为数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑色球数目为4,原子数目之比为1:1,故该氯化物的化学式是CuCl,晶胞质量为$\frac{99.5}{{N}_{A}}$g×4,测得其晶胞边长为acm,
则该晶体密度为$\frac{99.5}{{N}_{A}}$g×4÷(acm)3=$\frac{398}{{N}_{A}×{a}^{3}}$g/cm3,
故答案为:CuCl;$\frac{398}{{N}_{A}×{a}^{3}}$.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、杂化轨道、等电子体、晶胞计算等,推断元素是解题关键,需要学生具备扎实的基础,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA | |
| B. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA | |
| C. | 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
①溶液的酸性越强,水的电离度就越小
②升高温度,弱酸、弱碱溶液中的c(H+)、c(0H-)一定增大
③强酸溶液的酸性-定强于弱酸溶液的酸性
④因为c(H+)=c•α,所以在一定温度下稀释某一元弱酸时,c(H+)与α成正比.
| A. | ①③ | B. | ②④ | C. | ①③④ | D. | ②③④ |
| A. | 对于吸热反应,由于吸收热量后反应体系的温度升高 | |
| B. | 对于吸热反应,生成物的总能量,高于反应物的总能量 | |
| C. | 对于放热反应,放出热量后反应体系的温度降低 | |
| D. | 对于放热反应,生成物的总能量高于反应物的总能量 |
| A. | 常温常压下,O2和O3组成的混合气48g中所含氧原子数为3NA | |
| B. | 0.1mol•L-1硫酸溶液中含有H+个数为0.2 NA | |
| C. | 1molFe与足量盐酸反应,Fe失去电子数为3NA | |
| D. | 1.8g NH4+中含有的电子数为1.1 NA |
| A. | 0.9375d | B. | 0.9685d | C. | 1.0655d | D. | 0.9135d |

