题目内容
4.NA为阿伏加德罗常数,下列叙述正确的是( )| A. | 1.0L1.0mo1•L-1的NaNO3水溶液中含有的氧原子数为3NA | |
| B. | 0.1molCu与足量的浓硫酸反应生成SO2的体积为2.24L | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 反应Cl2+2NaOH=NaCl+NaClO+H2O中,每消耗1molCl2转移电子数为 NA |
分析 A、NaNO3水溶液中,除了NaNO3含有氧原子,水中也含氧原子;
B、二氧化硫所处的状态不明确;
C、溶液体积不明确;
D、反应Cl2+2NaOH=NaCl+NaClO+H2O中是氯气的歧化反应,转移1mol电子.
解答 解:A、NaNO3水溶液中,除了NaNO3含有氧原子,水中也含氧原子,故溶液中的氧原子的个数大于3NA个,故A错误;
B、0.1molCu与足量的浓硫酸反应生成SO2的物质的量为0.1mol,但由于二氧化硫所处的状态不明确,不一定是标况下,则气体不一定是2.24L,故B错误;
C、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故C错误;
D、反应Cl2+2NaOH=NaCl+NaClO+H2O中是氯气的歧化反应,转移1mol电子,消耗1mol氯气,故当消耗1mol氯气时转移1mol电子即NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
12.下列药品与其作用匹配的是( )
| A. | 胃舒平(中和过多胃酸) | B. | 阿司匹林(消炎杀菌) | ||
| C. | 青霉素(解热镇痛) | D. | 环丙沙星(抑制胃酸分泌) |
16.从碳骨架形状进行分类,下列关于各有机物的说法中正确的是( )
①CH3CH2Cl、②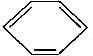 ③(CH3)2C═CH2④
③(CH3)2C═CH2④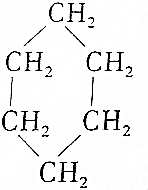 ⑤
⑤
①CH3CH2Cl、②
 ③(CH3)2C═CH2④
③(CH3)2C═CH2④ ⑤
⑤
| A. | 链状烃:①③⑤ | B. | 链状烃:①③ | C. | 环状烃:②④⑤ | D. | 芳香烃:②④ |
13. 实验室某浓硫酸试剂瓶上的标签如表所示,试根据标签上的有关数据回答下列问题:
实验室某浓硫酸试剂瓶上的标签如表所示,试根据标签上的有关数据回答下列问题:
(1)该浓硫酸中 H2SO4的物质的量浓度为18.4mol•L-1.
(2)某同学欲配制500mL物质的量浓度为0.30mol•L-1的稀硫酸,经计算需要8.15mL上述浓硫酸,则在实验操作中该同学需要量取8.2mL浓硫酸进行配制.若实验仪器有:A.100mL量筒;B.托盘天平;C.玻璃棒;D.50mL容量瓶;E.10mL量筒;F.胶头滴管;G.烧杯;H.500mL容量瓶.实验时应选用仪器按操作的先后顺序是E→G→C→H→A→F→(填字母).
(3)下列情况会使所配溶液浓度偏高的是AD
A.浓硫酸稀释后未冷却即转移
B.容量瓶使用前内壁沾有水珠
C.加蒸馏水时,不慎超过了刻度线
D.某同学观察液面的情况如图所示
(4)在容量瓶的使用方法中,下列操作不正确的是BC(填字母).
A.使用容量瓶前检查他是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1-2cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切
D.在容量瓶中转移溶液时应用玻璃棒引流.
 实验室某浓硫酸试剂瓶上的标签如表所示,试根据标签上的有关数据回答下列问题:
实验室某浓硫酸试剂瓶上的标签如表所示,试根据标签上的有关数据回答下列问题:| 硫酸 化学式 H2SO4 相对分子质量98 密度 1.84g/cm3 质量分数98% |
(2)某同学欲配制500mL物质的量浓度为0.30mol•L-1的稀硫酸,经计算需要8.15mL上述浓硫酸,则在实验操作中该同学需要量取8.2mL浓硫酸进行配制.若实验仪器有:A.100mL量筒;B.托盘天平;C.玻璃棒;D.50mL容量瓶;E.10mL量筒;F.胶头滴管;G.烧杯;H.500mL容量瓶.实验时应选用仪器按操作的先后顺序是E→G→C→H→A→F→(填字母).
(3)下列情况会使所配溶液浓度偏高的是AD
A.浓硫酸稀释后未冷却即转移
B.容量瓶使用前内壁沾有水珠
C.加蒸馏水时,不慎超过了刻度线
D.某同学观察液面的情况如图所示
(4)在容量瓶的使用方法中,下列操作不正确的是BC(填字母).
A.使用容量瓶前检查他是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1-2cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切
D.在容量瓶中转移溶液时应用玻璃棒引流.
10.下列叙述正确的是( )
| A. | 使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高 | |
| B. | 78 gNa2O2溶于1 L水配成溶液,可得到1 mol•L-1 NaOH溶液 | |
| C. | 标准状况下22.4LH2O所含分子数为NA | |
| D. | 100mL0.2mol•L-1的FeCl3溶液中,含Fe3+数为0.02NA |
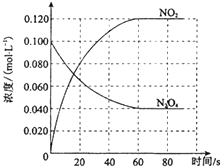 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)═2NO2(g)△H,随温度升高,混合气体的颜色变深.
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)═2NO2(g)△H,随温度升高,混合气体的颜色变深.