题目内容
10.下列叙述正确的是( )| A. | 使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高 | |
| B. | 78 gNa2O2溶于1 L水配成溶液,可得到1 mol•L-1 NaOH溶液 | |
| C. | 标准状况下22.4LH2O所含分子数为NA | |
| D. | 100mL0.2mol•L-1的FeCl3溶液中,含Fe3+数为0.02NA |
分析 A.俯视刻度线定容后,液面在刻度线下方,所得溶液体积偏小,结合c=$\frac{n}{V}$判断;
B.78 gNa2O2物质的量为1mol,溶于水得到2molNaOH;
C.标况下水不是气体;
D.溶液中Fe3+离子水解,其浓度小于0.2mol/L.
解答 解:A.俯视刻度线定容后,液面在刻度线下方,所得溶液体积偏小,根据c=$\frac{n}{V}$可知所配溶液浓度偏大,故A正确;
B.78 gNa2O2物质的量为1mol,溶于1L水得到2molNaOH,所得溶液浓度为2mol/L,故B错误;
C.标况下水不是气体,22.4LH2O的物质的量远远大于1mol,故C错误;
D.溶液中Fe3+离子水解,其浓度小于0.2mol/L,100mL0.2mol•L-1的FeCl3溶液中,含Fe3+数小于0.02NA,故D错误,
故选:A.
点评 本题考查一定物质的量溶液配制、物质的量计算、盐类水解等,注意对基础知识的理解掌握,注意气体摩尔体积的使用条件与对象.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
4.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 1.0L1.0mo1•L-1的NaNO3水溶液中含有的氧原子数为3NA | |
| B. | 0.1molCu与足量的浓硫酸反应生成SO2的体积为2.24L | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 反应Cl2+2NaOH=NaCl+NaClO+H2O中,每消耗1molCl2转移电子数为 NA |
1.已知:工业上制硫酸在接触室中发生的反应为:2SO2(g)+O2(g)?2SO3(g),其正反应是一个放热反应.
(1)①相同条件下,2mol SO2和1mol O2所具有的能量>(填“>”、“<”或“=”)2mol SO3具有的能量;
②在相同条件下,若断开2mol SO2、1molO2和2mol SO3中的化学键时,吸收的能量分别为Q1、Q2、Q3,则Q1+Q2<Q3(填“>”、“<”或“=”);
③在一定条件下,当该反应生成2molSO3时,放出197kJ的热量,该条件下,如果将3mol SO2和1mol O2混合,使其充分反应,放出的热量<197kJ(填“>”、“<”或“=”),反应达到平衡后,n(SO2)+n(SO3)=3mol.
(2)科研人员设想用如图所示装置生产硫酸,
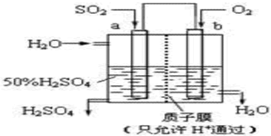
①通入O2的b极是原电池正极(填“正”或“负”);
②电解质溶液中阴离子向a极移动(填“a”或“b”);
③负极反应式为2SO2-4e-+4H2O=2SO42-+8H+.
(3)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入0.5L密闭容器内,550℃时,在催化剂作用下充分发生反应.测得n(O2)随时间的变化如下表
反应达到5s后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了22.4L(此体积为标准状况下的体积);再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(此体积为标准状况下的体积).
请回答下列问题:
①用O2表示从1~2s内该反应的平均反应速率为0.2mol•L-1•s-1;
②该反应达到平衡时,SO2的转化率为90%(用百分数表示);
③该反应达到平衡时,O2的体积分数是6.2%(用百分数表示);
④若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因可能是:该反应是放热反应,反应开始后放出的热量使体系的温度升高,反应速率加快;一段时间后,随着浓度的减小,化学反应速率减慢.
(1)①相同条件下,2mol SO2和1mol O2所具有的能量>(填“>”、“<”或“=”)2mol SO3具有的能量;
②在相同条件下,若断开2mol SO2、1molO2和2mol SO3中的化学键时,吸收的能量分别为Q1、Q2、Q3,则Q1+Q2<Q3(填“>”、“<”或“=”);
③在一定条件下,当该反应生成2molSO3时,放出197kJ的热量,该条件下,如果将3mol SO2和1mol O2混合,使其充分反应,放出的热量<197kJ(填“>”、“<”或“=”),反应达到平衡后,n(SO2)+n(SO3)=3mol.
(2)科研人员设想用如图所示装置生产硫酸,

①通入O2的b极是原电池正极(填“正”或“负”);
②电解质溶液中阴离子向a极移动(填“a”或“b”);
③负极反应式为2SO2-4e-+4H2O=2SO42-+8H+.
(3)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入0.5L密闭容器内,550℃时,在催化剂作用下充分发生反应.测得n(O2)随时间的变化如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(O2)/mol | 0.7 | 0.4 | 0.3 | x | x | x |
请回答下列问题:
①用O2表示从1~2s内该反应的平均反应速率为0.2mol•L-1•s-1;
②该反应达到平衡时,SO2的转化率为90%(用百分数表示);
③该反应达到平衡时,O2的体积分数是6.2%(用百分数表示);
④若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因可能是:该反应是放热反应,反应开始后放出的热量使体系的温度升高,反应速率加快;一段时间后,随着浓度的减小,化学反应速率减慢.
5.工业上可以从电解铜的阳极泥中提取很多重要物质,其工艺流程如图:
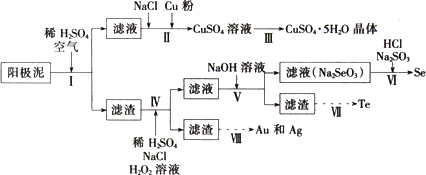
已知:①阳极泥的主要化学成分,如表所示
②温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表所示:
(1)步骤I的主要目的为浸出铜,此过程中发生的主要反应的化学方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O.分析如表数据,可知步骤I最适合的条件为硫酸浓度3mol•L-1、浸出温度40℃.
(2)步骤Ⅱ中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为除去滤液中的Ag+.
(3)步骤Ⅲ的操作方法为蒸发浓缩、冷却结晶、过滤.
(4)步骤Ⅳ中,反应温度为75℃.加入H2O2溶液的作用为氧化滤渣中的硒和碲,使其进入溶液中;此过程中H2O1溶液的添加量要远远高于理沧值,原因为增加硒和碲的浸出率、H2O2会有部分分解.
(5)步骤Ⅵ中所发生反应的化学方程式为Na2SeO3+2Na2SO3+2HCl=Se+2Na2SO4+2NaCl+H2O.
(6)步骤Ⅶ中,Te的获得可以通过碱性环境下电解Na2TeO3溶液实现,其阴极的电极反应式为TeO32-+4e-+3H2O=Te+6OH-.

已知:①阳极泥的主要化学成分,如表所示
| 主要成分 | Cu | Ag | Au | Se | Te |
| 百分含量/% | 23.4 | 12.1 | 0.9 | 6.7 | 3.1 |
| 固定浸出温度 | 固定H2SO4浓度 | |||||||||||
| H2SO4浓度/mol•L-1 | 浸出率/% | 浸出温度/℃ | 浸出率/% | |||||||||
| Cu | Ag | Au | Se | Te | Cu | Ag | Au | Se | Te | |||
| 4 | 95.1 | 4.67 | <0.2 | 0.83 | 8.93 | 30 | 87.1 | 4.58 | <0.2 | 0.08 | 6.83 | |
| 3 | 94.5 | 4.65 | <0.2 | 0.28 | 6.90 | 40 | 94.5 | 4.65 | <0.2 | 0.28 | 6.90 | |
| 2 | 78.1 | 2.65 | <0.2 | 0.05 | 2.85 | 50 | 96.1 | 5.90 | <0.2 | 0.64 | 8.73 | |
(2)步骤Ⅱ中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为除去滤液中的Ag+.
(3)步骤Ⅲ的操作方法为蒸发浓缩、冷却结晶、过滤.
(4)步骤Ⅳ中,反应温度为75℃.加入H2O2溶液的作用为氧化滤渣中的硒和碲,使其进入溶液中;此过程中H2O1溶液的添加量要远远高于理沧值,原因为增加硒和碲的浸出率、H2O2会有部分分解.
(5)步骤Ⅵ中所发生反应的化学方程式为Na2SeO3+2Na2SO3+2HCl=Se+2Na2SO4+2NaCl+H2O.
(6)步骤Ⅶ中,Te的获得可以通过碱性环境下电解Na2TeO3溶液实现,其阴极的电极反应式为TeO32-+4e-+3H2O=Te+6OH-.
15.下列溶液中,与100ml 0.5mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
| A. | 100ml 0.5mol/L MgCl2溶液 | B. | 200ml 0.25mol/L HCl溶液 | ||
| C. | 50ml 1mol/L NaCl溶液 | D. | 200ml 0.25mol/L CaCl2溶液 |
2.下列实验装置能达到实验目的是( )
| A. | 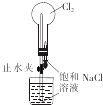 进行喷泉实验 | B. | 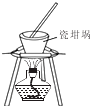 加热熔融(NaOH) | ||
| C. | 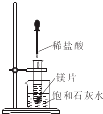 验证镁片与稀盐酸反应放热 | D. | 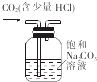 除去CO2中的少量HCl |
19.已知 HCN 的电离常数 K=6.2×10-10.用物质的量都是0.1mol 的HCN和NaCN混合后配成1L溶液,经测定溶液呈碱性.则下列关系式正确的是( )
| A. | c(CN-)>c(Na+) | B. | c(CN-)>c(HCN) | ||
| C. | c(HCN)+c(CN-)=0.2mol•L-1 | D. | c(CN-)+c(OH-)=0.1mol•L-1 |
20.在一个不传热的固定容积的密闭容器中发生可逆反应:mA(g)+nB(g)═pC(g)+qD(g),当m、n、p、q为任意整数(不为零)时,一定能说明达到平衡状态的标志是( )
| A. | 各组分的浓度不再改变 | |
| B. | 体系的压强不再改变 | |
| C. | 反应速率υA:υB:υC:υD=m:n:p:q | |
| D. | 单位时间内m mol A断键发生反应,同时n mol B也断键发生反应 |
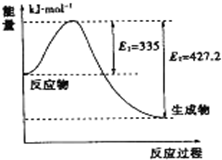 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.