题目内容
19.研究N0x、SO2等大气污染气体的处理有重要意义.(1)NO2可用水吸收,相应的化学方程式为3NO2+H2O=2HNO3+NO.利用反应:6NO2+8NH$\frac{\underline{催化剂}}{△}$7N2+12H2O也可以处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是6.72L.
(2)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1;
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1;
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=-41.8 kJ•mol-1.
(3)大气中SO2和NOx是形成酸雨的主要污染气体.某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等.某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:第一份酸化后滴加适量的淀粉KI溶液,呈蓝色;第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色.已知:Ksp(Ag2SO4)=1.20×10-5
请回答下列问题:
①该酸雨中肯定存在的离子有SO42-、NO3-、NH4+;肯定不存在的离子有SO32-、NO2-,说明其不存在的理由:SO32-具有较强的还原性,酸性条件下,与NO3-不能共存;若有NO2-,能使酸性KMnO4溶液褪色.
②写出试液中滴加淀粉KI溶液所发生反应的离子方程式:6I-+2NO3-+8H+=3I2+2NO↑+4H2O.
③该研究小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,该过程中发生的化学反应有2NO+O2=2NO2、NO2+SO2=SO3+NO,再喷射适量蒸馏水即得硫酸型酸雨.说明NO的作用:催化剂.
分析 (1)根据物质与水的反应物与生成物来书写化学反应方程式,再利用氧化还原反应中电子转移计算,然后来计算标准状况下气体的体积;
(2)利用盖斯定律来计算反应热;
(3)①根据离子共存的知识来确定溶液中的离子的存在与否;
②根据单质碘能使淀粉KI溶液呈蓝色来分析;
③根据一氧化氮在反应中的特点来判断所起到的作用.
解答 解:(1)NO2与H2O反应的方程式为:3NO2+H2O═2HNO3+NO;6NO2+8NH3═7N2+12H2O,当反应中有1 mol NO2参加反应时,共转移了4 mol电子,故转移1.2mol电子时,消耗的NO2为:$\frac{1.2mol}{4}$×22.4L/mol=6.72L,
故答案为:3NO2+H2O=2HNO3+NO;6.72;
(2)根据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相加得:2NO2+2SO2═2SO3+2NO,△H=-83.6 kJ•mol-1,故NO2+SO2?SO3+NO,△H=-41.8 kJ•mol-1,
故答案为:-41.8;
(3)①滴加适量的淀粉KI溶液,呈蓝色,说明在该酸性溶液中有一种能将碘离子氧化为碘单质的离子存在,而这样的离子只有NO3-,故一定含有NO3-,就一定不会含有SO32-,因为SO32-具有较强的还原性,酸性条件下,与NO3-不能共存;滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出,故一定含有SO42-;滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则有氨气生成,故一定含有NH4+;加入足量硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色,一定不含NO2-,若有NO2-,能使酸性KMnO4褪色,而氯离子的存在与否不能判断,因为硫酸根已经存在,
故答案为:SO42-、NO3-、NH4+;SO32-、NO2-;SO32-具有较强的还原性,酸性条件下,与NO3-不能共存;若有NO2-,能使酸性KMnO4溶液褪色;
②硝酸氧化碘离子的离子方程式为:6I-+2NO3-+8H+=3I2+2NO↑+4H2O,
故答案为:6I-+2NO3-+8H+=3I2+2NO↑+4H2O;
③根据反应方程式2NO+O2=2NO2、NO2+SO2=SO3+NO可知,整个过程NO的质量没有变化,故在反应中作催化剂,
故答案为:催化剂.
点评 本题考查了性质实验方案的设计、热化学方程式的计算、离子推断等知识,题目难度中等,注意掌握盖斯定律在热化学方程式计算中的应用方法,明确性质实验方案设计的原则,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用能力.

 阅读快车系列答案
阅读快车系列答案 下列说法正确的是( )
下列说法正确的是( )| A. | 该有机物属于芳香烃 | B. | 该有机物易溶于水 | ||
| C. | 该有机物不能发生加成反应 | D. | 该有机物能发生取代反应 |
| A. | 氢氧化铁与盐酸反应OH-+H+═H2O | |
| B. | 次氯酸钠溶液中通入少量CO2 2ClO-+CO2+H2O═2HClO+CO${\;}_{3}^{2-}$ | |
| C. | 硫酸氢钠溶液中加入氢氧化钡溶液至沉淀完全 Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O | |
| D. | 钠与水反应 Na+2H2O═Na++2OH-+H2↑ |
①晨雾中看见叶缝透过光束的通路 ②用明矾净水 ③一支钢笔使用不同牌号的蓝黑墨水易出现堵塞 ④静电除尘 ⑤豆浆做豆花 ⑥血液透析 ⑦在江河入海口处容易形成沙洲( )
| A. | ①②⑤⑦ | B. | ①③④⑤⑥ | C. | ①③⑤⑥⑦ | D. | 全部都有关 |
| A. | 1.0L1.0mo1•L-1的NaNO3水溶液中含有的氧原子数为3NA | |
| B. | 0.1molCu与足量的浓硫酸反应生成SO2的体积为2.24L | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 反应Cl2+2NaOH=NaCl+NaClO+H2O中,每消耗1molCl2转移电子数为 NA |
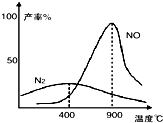 氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如下图):
氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如下图):4NH3+5O2?4NO+6H2O;
4NH3+3O2?2N2+6H2O
温度较低时以生成N2为主,温度高于900℃时,NO产率下降的原因生成NO的反应为放热反应,升高温度转化率下降;进一步与NO反应生成硝酸.
(4)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)═4NO2(g)+O2(g)△H>0,如表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
②下列情况能说明该反应已达平衡状态的是BD.
A.单位时间内生成2mol NO2的同时消耗了lmol N2O5 B.混合气体的颜色不再发生变化
C.混合气体的密度保持不变 D.在绝热恒容的容器中,反应的平衡常数不再变化.
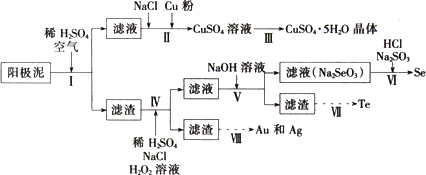
已知:①阳极泥的主要化学成分,如表所示
| 主要成分 | Cu | Ag | Au | Se | Te |
| 百分含量/% | 23.4 | 12.1 | 0.9 | 6.7 | 3.1 |
| 固定浸出温度 | 固定H2SO4浓度 | |||||||||||
| H2SO4浓度/mol•L-1 | 浸出率/% | 浸出温度/℃ | 浸出率/% | |||||||||
| Cu | Ag | Au | Se | Te | Cu | Ag | Au | Se | Te | |||
| 4 | 95.1 | 4.67 | <0.2 | 0.83 | 8.93 | 30 | 87.1 | 4.58 | <0.2 | 0.08 | 6.83 | |
| 3 | 94.5 | 4.65 | <0.2 | 0.28 | 6.90 | 40 | 94.5 | 4.65 | <0.2 | 0.28 | 6.90 | |
| 2 | 78.1 | 2.65 | <0.2 | 0.05 | 2.85 | 50 | 96.1 | 5.90 | <0.2 | 0.64 | 8.73 | |
(2)步骤Ⅱ中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为除去滤液中的Ag+.
(3)步骤Ⅲ的操作方法为蒸发浓缩、冷却结晶、过滤.
(4)步骤Ⅳ中,反应温度为75℃.加入H2O2溶液的作用为氧化滤渣中的硒和碲,使其进入溶液中;此过程中H2O1溶液的添加量要远远高于理沧值,原因为增加硒和碲的浸出率、H2O2会有部分分解.
(5)步骤Ⅵ中所发生反应的化学方程式为Na2SeO3+2Na2SO3+2HCl=Se+2Na2SO4+2NaCl+H2O.
(6)步骤Ⅶ中,Te的获得可以通过碱性环境下电解Na2TeO3溶液实现,其阴极的电极反应式为TeO32-+4e-+3H2O=Te+6OH-.