题目内容
【题目】研究氮氧化物的反应机理,对于消除对环境的污染有重要意义。升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)![]() 2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)
2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快);v1正=k1正c2(NO);v1逆=k1逆c(N2O2)H1<0
N2O2(g)(快);v1正=k1正c2(NO);v1逆=k1逆c(N2O2)H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢);v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)H2<0
2NO2(g)(慢);v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)H2<0
请回答下列问题:
(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H= (用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H= (用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1 E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是 。
2NO2(g)速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1 E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是 。
A.k2正增大,c(N2O2)增大
B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小
D.k2正减小,c(N2O2)增大
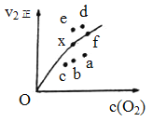
由实验数据得到v2正~[O2]的关系可用右图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为 (填字母)。
(3)工业上可用氨水作为NO2的吸收剂,NO2通入氨水发生的反应:2NO2+2NH3·H2O=NH4NO3+NH4NO2+H2O。若反应后的溶液滴入甲基橙呈红色,则反应后溶液中c(NH4+) c(NO3-)+c(NO2-)(填“>”“<”或“=”)。工业上也可用电解法处理氮氧化物的污染。电解池如图所示,阴阳电极间是新型固体氧化物陶瓷,在一定条件下可传导O2-。
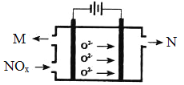
该电解池阴极的电极反应式是 。阳极产生的气体N的化学式是 。
【答案】
(1)△H1+△H2;![]() ;减小;
;减小;
(2)<;c;a;
(3)<;2NOx+4xe-=N2+2xO2-;O2。
【解析】
试题分析:(1)①2NO(g)![]() N2O2(g);②N2O2(g)+O2(g)
N2O2(g);②N2O2(g)+O2(g)![]() 2NO2(g),而目标反应2NO(g)+O2(g)2NO2(g)的△H=①+②=△H1+△H2,由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),则是K=
2NO2(g),而目标反应2NO(g)+O2(g)2NO2(g)的△H=①+②=△H1+△H2,由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),则是K=![]() =
=![]() ,而正反应是放热反应,所以升高温度,平衡常数减小,故答案为:△H1+△H2;
,而正反应是放热反应,所以升高温度,平衡常数减小,故答案为:△H1+△H2;![]() ;减小;
;减小;
(2)因为决定2NO(g)+O2(g)![]() 2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;决定反应速率的是反应②,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,导致两者的积减小;v2正升高到某一温度时v2正减小,平衡逆向移动,氧气的浓度增大,所以反应重新达到平衡,则变为相应的点为a,故答案为:<;c;a;
2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;决定反应速率的是反应②,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,导致两者的积减小;v2正升高到某一温度时v2正减小,平衡逆向移动,氧气的浓度增大,所以反应重新达到平衡,则变为相应的点为a,故答案为:<;c;a;
(3)根据电荷守恒c(NH4+)+c(H+)=c(NO3-)+c(NO2-)+c(OH-),而甲基橙呈红色,说明溶液呈酸性c(H+)>c(OH-),所以c(NH4+)<c(NO3-)+c(NO2-),O2-在阳极发生氧化反应生成氧气,所以气体N为O2,而氮的氧化物在阴极发生还原反应生成氮气,阴极的电极反应式:2NOx+4xe-=N2+2xO2-,故答案为:<;2NOx+4xe-=N2+2xO2-;O2。

 阅读快车系列答案
阅读快车系列答案