题目内容
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·-1的NaOH溶液。请回答:

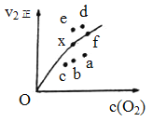
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化的关系如图所示,当V1=160 mL时,则金属粉末中n(Mg)=______________mol,V2=_____________ mL。
(2)若混合物仍为0.1 mol,其中Mg粉物质的量分数为a ,用100 mL2mol·L-1的H2SO4溶解此混合物后,再加入450mL1mol/LNaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是______________。
【答案】0.064400.05≤a<0.1
【解析】发生的反应①Mg+2H+=Mg2++H2↑、②2Al+6H+=2Al3++3H2↑、③H++OH-=H2O、④Mg2++2OH-=Mg(OH)2↓、⑤Al3++3OH-=Al(OH)3↓、⑥Al(OH)3+OH-=AlO2-+2H2O,(1)设Mg的物质的量为xmol,则Al的物质的量为(0.1-x)mol,V1=160ml时,和金属反应消耗的H+的物质的量为(100×10-3×2×2-160×10-3×1)mol=0.24mol,因此有2x+6(0.1-x)/2=0.24,解得x=0.06mol,V2时,溶液中溶质为Na2SO4、NaAlO2,根据电荷守恒以及元素守恒,n(Na+)=n(AlO2-)+2n(SO42-)=0.04+2×100×10-3×2mol=0.44mol,因此V2=0.44×103/1ml=440mL;(2)沉淀中无Al(OH)3,溶液此时溶质为NaAlO2、Na2SO4,当NaOH过量,此时溶液中还含有NaOH,因此根据元素守恒,n(NaOH)=450×10-3×1≥n(AlO2-)+2n(SO42-)=0.1×(1-a)+2×100×10-3×2mol,解得a≥0.5,因此范围是0.5≤a<1

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案