题目内容
2.请根据题意选择下列物质:A.明矾[KAI(SO4)2•12H2O]B.Fe2O3
C.NaHCO3 D.熟石灰[Ca(OH)2],
并用其字母代号填空:
(1)一种红棕色粉末,常用作红色油漆和涂料的是B
(2)要使含泥沙的洪水变澄清,可使用A;
(3)要中和钢铁厂、电镀厂产生的酸性废水,可使用D;
(4)使焙制糕点松软可以添加C.
分析 (1)常用作红色油漆和涂料的是氧化铁;
(2)明矾可用于净水;
(3)中和钢铁厂、电镀厂产生的酸性废水,应用碱性物质;
(4)小苏打常用于焙制糕点.
解答 解:(1)氧化铁性质稳定,颜色为红色,可用作红色油漆和涂料,故答案为:B;
(2)明矾可水解生成具有吸附性的氢氧化铝胶体,可用于净水,故答案为:A;
(3)中和钢铁厂、电镀厂产生的酸性废水,应用碱性物质,应选择氢氧化钙,故答案为:D;
(4)小苏打常用于焙制糕点,故答案为:C.
点评 本题综合考查元素化合物知识,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,难度不大.

练习册系列答案
相关题目
12.以下物质间的每步转化中,有不能通过一步反应实现的是( )
| A. | SO2→SO3→H2SO4 | B. | Al2O3→Al(OH)3→NaAlO2 | ||
| C. | FeCl2→Fe(OH)2→Fe(OH)3 | D. | CH2=CH2→CH3CH2OH→CH3CHO |
13.在标准状况下进行甲、乙、丙三组实验.各取30mL同浓度的盐酸溶液,加入不同质量的同一种镁铝合金粉末,产生气体.有关数据记录如表:
试回答:
(1)盐酸一定过量的是(填序号)甲,盐酸一定不足量的是乙和丙;
(2)要计算合金中镁的质量分数,所提供的数据中作计算依据的是甲,镁在合金中的质量分数为53.3%;
(3)在丙组实验之后,向容器中加入1mol/L的苛性钠溶液,可恰好使铝元素全部以偏铝酸根形式存在,并使镁离子
刚好沉淀完全,则溶液中偏铝酸钠的物质的量为0.009mol,所加入的苛性钠溶液的体积为39mL.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量g | 0.255 | 0.385 | 0.459 |
| 生成气体体积/mL | 280 | 336 | 336 |
(1)盐酸一定过量的是(填序号)甲,盐酸一定不足量的是乙和丙;
(2)要计算合金中镁的质量分数,所提供的数据中作计算依据的是甲,镁在合金中的质量分数为53.3%;
(3)在丙组实验之后,向容器中加入1mol/L的苛性钠溶液,可恰好使铝元素全部以偏铝酸根形式存在,并使镁离子
刚好沉淀完全,则溶液中偏铝酸钠的物质的量为0.009mol,所加入的苛性钠溶液的体积为39mL.
10.下列各组中的离子,能在溶液中大量共存的是( )
| A. | H+、Mg2+、OH-、Cl- | B. | H+、Na+、SO42-、CO32- | ||
| C. | K+、Ag+、Cl-、NO3- | D. | Ca2+、K+、Cl-、NO3- |
17.我国是一个淡水资源比较匮乏的国家,下列方法能直接从海水制取可饮用水的是( )
| A. | 萃取 | B. | 结晶 | C. | 蒸馏 | D. | 过滤 |
7.可能造成光化学烟雾污染的气体是( )
| A. | SO2 | B. | NO2 | C. | CO2 | D. | CO |
17.下表是元素周期表的一部分,请用元素符号或化学式回答有关问题:
(1)表中化学性质最不活泼的元素是Ar,最活泼的金属元素是K,最活泼的非金属元素是F.
(2)表中能形成两性氧化物的元素是Al,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)③⑥⑦三种元素原子半径由大到小的顺序是S>Cl>F.
(4)用电子式表示由元素⑨⑦形成化合物的过程:K++ →
→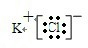 .
.
(5)③元素与⑩元素两者核电荷数之差是26.
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)表中能形成两性氧化物的元素是Al,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)③⑥⑦三种元素原子半径由大到小的顺序是S>Cl>F.
(4)用电子式表示由元素⑨⑦形成化合物的过程:K++
 →
→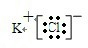 .
.(5)③元素与⑩元素两者核电荷数之差是26.
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表.
| 实验步骤 | 实验现象与结论 |
18.下列有关说法不正确的是( )
| A. | 在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(NH4+)减小 | |
| B. | 相同体积、pH均为3的HA和HB两种酸分别与足量的锌充分反应,HA放出的氢气多,说明HB的酸性比HA的酸性强 | |
| C. | 工业电解食盐水中,电解池被阳离子交换膜隔成阴极室和阳极室,目的是避免阳极产生的气体与烧碱反应 | |
| D. | 在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |