题目内容
17.下列物质的电子式中,书写正确的是( )| A. | 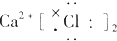 | B. | 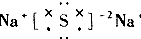 | C. | 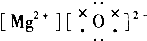 | D. | 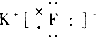 |
分析 A.氯离子表示错误,且氯化钙的电子式中两个氯离子分别写在镁离子两边;
B.硫化钠为离子化合物,硫离子带2个负电荷,为2-;
C.氧化镁中,镁离子带正电,不需要中括号;
D.氯化钾是离子化合物.
解答 解:A.氯化钙为离子化合物,氯离子需要标出电荷,且分别写在镁离子两边,正确的电子式为: ,故A错误;
,故A错误;
B.硫化钠为离子化合物,硫离子带2个负电荷,硫化钠的电子式为: ,故B错误;
,故B错误;
C.氧化镁中,镁离子带正电,不需要中括号,氧化镁的电子式为: ,故C错误;
,故C错误;
D.氯化钾为离子化合物,其电子式为: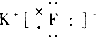 ,故D正确;
,故D正确;
故选D.
点评 本题考查了电子式、结构式的表示方法,题目难度中等,注意掌握电子式、结构式的概念及表示方法,明确离子化合物与共价化合物的电子式的区别.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.化学与生活息息相关,下列说法不正确的是( )
| A. | 用食醋可除去热水壶内壁的水垢 | |
| B. | 淀粉,油脂和蛋白质都是高分子化合物 | |
| C. | 乙醇、乙酸均能与Na反应放出H2,但二者分子中官能团不同 | |
| D. | 甲烷和Cl2的反应与乙烯和Br2的反应不属于同一类型的反应 |
9.x、y为两元素的原子,x的阴离子与y的阳离子的电子层结构相同,由此可知( )
| A. | x的原子半径大于y的原子半径 | |
| B. | x的第一电离能小于y 的第一电离能 | |
| C. | x的金属性大于y的金属性 | |
| D. | x的电负性大于y的电负性 |
6.下列对于“摩尔”的理解正确的是( )
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,0.012kg碳原子所含有的碳原子数目为1摩 |

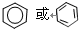 .
.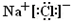 ,Na在F单质中燃烧的产物是Na2O2.
,Na在F单质中燃烧的产物是Na2O2.