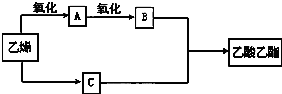
题目内容
8.甲醇可作为燃料电池的原料.CH4和H2O为原料,通过下列反应反应来制备甲醇.Ⅰ:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.0KJ•mol-1
Ⅱ:CO(g)+2H2(g)═CH3OH(g)△H=-129.0KJ•mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为:CH4(g)+H2O(g)=CH3OH (g)+H2(g)△H=+77kJ•mol-1.
(2)将1.OmolCH4和2.0molH2O(g)通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.

①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为0.003 mol•L-1•min-1.
②100℃时反应I的平衡常数为2.25×10-4.
(3)在压强为0.1MPa、温度为300℃条件下,将amolCO与3amolH2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的$\frac{1}{2}$,其他条件不变,对平衡体系产生的影响是CH3OH-6e-+8OH-═CO32-+6H2O.(填字母序号).
A.c(H2)减少;B.正反应速率加快,逆反应速率减慢;C.CH3OH的物质的量增加;D.重新平衡c(H2)/c(CH3OH)减小;E.平衡常数K增大
(4)写出甲醇-空气-KOH溶液的燃料电池正极的电极反应式:Co2+-e-=Co3+.
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用图2装置模拟上述过程:
①写出阳极电极反应式Co2+-e-=Co3+.
②写出除去甲醇的离子方程式6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
分析 (1)已知,I:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ•mol-1
II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ•mol-1
依据盖斯定律,Ⅰ+Ⅱ可得:CH4(g)+H2O(g)=CH3OH (g)+H2(g),反应热也进行相应计算;
(2)由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始(mol):1.0 2.0 0 0
变化(mol):0.5 0.5 0.5 1.5
平衡(mol):0.5 1.5 0.5 1.5
①根据v=$\frac{△c}{△t}$计算H2表示该反应的平均反应速率;
②根据K=$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})×c({H}_{2}O)}$计算;
(3)平衡后将容器的容积压缩到原来的$\frac{1}{2}$,其他条件不变,体积减小压强增大,正、逆反应速率增大,正反应速率增大更多,平衡正向进行,平衡常数只受温度影响,与浓度无关,则平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大;
(4)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根与水;
(5)①阳极发生氧化反应,Co2+失去电子生成Co3+;
②Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式.
解答 解:(1)已知,I:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ•mol-1
II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ•mol-1
依据盖斯定律,Ⅰ+Ⅱ可得:CH4(g)+H2O(g)=CH3OH (g)+H2(g)△H=+77kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CH3OH (g)+H2(g)△H=+77kJ•mol-1;
(2)由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始(mol):1.0 2.0 0 0
变化(mol):0.5 0.5 0.5 1.5
平衡(mol):0.5 1.5 0.5 1.5
①H2表示该反应的平均反应速率为=$\frac{\frac{1.5mol}{100mL}}{5min}$=0.003 mol•L-1•min-1,
故答案为:0.003 mol•L-1•min-1;
②平衡浓度为c(CH4)=0.005mol/L,c(H2O)=0.015mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,平衡常数K=$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})×c({H}_{2}O)}$=$\frac{0.005×0.01{5}^{3}}{0.005×0.015}$=2.25×10-4,
故答案为:2.25×10-4;
(3)平衡后将容器的容积压缩到原来的$\frac{1}{2}$,其他条件不变,体积减小压强增大,平衡正向进行.
A.生成物浓度增大,结合平衡常数不变,可知c(H2)增大,故A错误;
B.压强增大,正、逆反应速率都加快,但正反应速率增大更多,故B错误;
C.平衡正向进行,CH3OH的物质的量增加,故C正确;
D.平衡正向进行,氢气物质的量减小,甲醇物质的量增大,故重新平衡时$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小,故D正确;
E.平衡常数只受温度影响,温度不变,平衡常数不变,故E错误,
故选:CD;
(4)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根与水,负极电极反应式为:CH3OH-6e-+8OH-═CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-═CO32-+6H2O;
(5)①阳极发生氧化反应,Co2+失去电子生成Co3+,电极反应式为:Co2+-e-=Co3+,
故答案为:Co2+-e-=Co3+;
②Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,
故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
点评 本题属于拼合型题目,涉及热化学方程式书写、化学平衡图象、化学平衡影响因素、平衡常数与反应速率计算、原电池等,是对学生综合能力的考查,题目难度中等.

| A. | 96% | B. | 48% | C. | 9.6% | D. | 56% |
| A. | 碳酸钠用于治疗胃溃疡病人的胃酸过多症 | |
| B. | 金属钠具有强的还原性,可利用钠和TiCl4溶液反应制取金属Ti | |
| C. | 糖类、油脂、蛋白质在一定条件下均可以水解 | |
| D. | 硅酸钠水溶液呈碱性,可以用来制硅酸 |
| A. | 原子数 | B. | 密度 | C. | 质子数 | D. | 质量 |
| A. | ${\;}_{17}^{37}$Cl2的摩尔质量是74 | |
| B. | ${\;}_{17}^{37}$Cl、${\;}_{17}^{35}$Cl互为同位素,${\;}_{17}^{35}$Cl2与Cl2互为同分异构体 | |
| C. | 通常情况下,氯气做氧化剂,但氯气也具有还原性 | |
| D. | 能使湿润的淀粉KI试纸变蓝色的物质一定是Cl2 |
| A. | 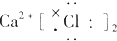 | B. | 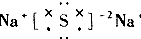 | C. | 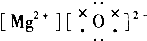 | D. |  |
| A. | Fe2+、H+、Na+、NO3- | B. | SiO32-、K+、Br-、H+ | ||
| C. | NH4+、Cl-、Mg2+、SO42- | D. | Na+、OH-、NH4+、I- |