题目内容
2.A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;B的阴离子与D的阳离子具有相同的电子排布,可与C形成化合物D2C.(1)B元素的名称氮;B在周期表中的位置第二周期,第ⅤA族;
(2)A、B形成的化合物的化学式NH3;
(3)C的元素符号S,C的最高价氧化物的化学式SO3
(4)D的最高价氧化物对应的水化物的化学式NaOH.
(5)A、B、C、D四种元素简单离子的离子半径由大到小的顺序是S2->N3->Na+>H+.
分析 A元素所处的周期数、主族序数、原子序数均相等,则A为H元素;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3,B的化合价为+5价,原子核外最外层电子数为5,则应为N元素;C元素原子的最外层电子数比次外层少2个,核外各电子层电子数分别为2、8、6,则C应为S元素;B的阴离子与D的阳离子具有相同的电子排布,可与C形成化合物D2C,则D的最外层电子数为1,位于周期表第三周期,应为Na元素,根据元素所在周期表中的位置,结合元素对应的化合物的性质解答该题.
解答 解:A元素所处的周期数、主族序数、原子序数均相等,则A为H元素;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3,B的化合价为+5价,原子核外最外层电子数为5,则应为N元素;C元素原子的最外层电子数比次外层少2个,核外各电子层电子数分别为2、8、6,则C应为S元素;B的阴离子与D的阳离子具有相同的电子排布,可与C形成化合物D2C,则D的最外层电子数为1,位于周期表第三周期,应为Na元素,
(1)B为N元素,核外各层电子分别为2、5,应在元素周期表第二周期ⅤA族,
故答案为:氮;二,ⅤA;
(2)A、B分别为H、N元素,二者形成的化合物为NH3,
故答案为:NH3;
(3)C为S元素,S元素最外层电子数为6,则最高正化合价为+6价,则最高价氧化物的化学式为SO3,
故答案为:S;SO3;
(4)D为Na元素,其对应的最高价氧化物对应的水化物为NaOH,
故答案为:NaOH;
(5)电子层越多半径越大,电子层相同时,核电荷数越大,离子半径越小,则四种元素简单离子的离子半径由大到小的顺序为:S2->N3->Na+>H+,
故答案为:S2->N3->Na+>H+.
点评 本题考查位置结构性质的相互关系应用,题目难度中等,正确推断元素的种类为解答该题的关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 原子数 | B. | 密度 | C. | 质子数 | D. | 质量 |
| A. | 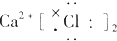 | B. | 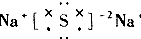 | C. | 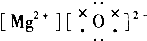 | D. | 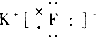 |
| A. | 铝与氢氧化钠反应 | |
| B. | 向氯化铝溶液中加入过量氨水 | |
| C. | 含氟牙膏中加入氯化铝并不断充分搅拌 | |
| D. | 向硫酸铜溶液中通入过量氨气 |
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出 | |
| C. | 制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干 | |
| D. | 重结晶时,溶液冷却速度越慢得到的晶体颗粒越小 |
①用托盘天平称取25.20gNaCl固体
②用铁坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用25mL碱式滴定管量取14.80mL 1mol/L NaOH溶液
⑤用湿润的pH试纸测定某溶液的pH
⑥实验室配制氯化铁溶液时,可以先将氯化铁溶解在盐酸中,再配制到所需要的浓度.
| A. | ②④⑥ | B. | ②③⑥ | C. | ①②④ | D. | ②③④⑤⑥ |
| A. | 标准状况下,22.4L SO3的分子数为1NA | |
| B. | 3.9g Na2O2固体中阴离子的数目为0.1NA | |
| C. | 1mol Cl2与1mol Fe反应,转移的电子数为2NA | |
| D. | 0.1molN2和C18O含有的中子数均为1.4NA |
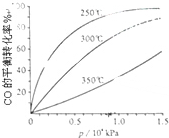 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.