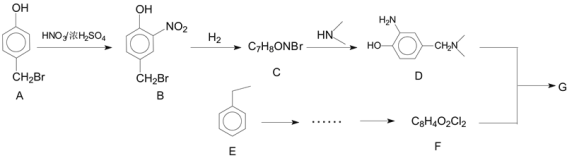
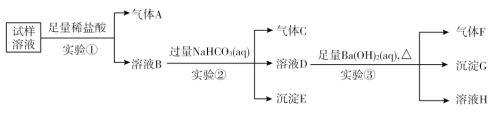
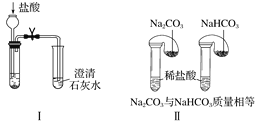
题目内容
【题目】某次实验需用0.4 mol/LNaOH溶液480mL。配制方法如下:
(1)配制该溶液应选用________mL容量瓶;
(2)用托盘天平准确称量________g固体NaOH,应放在________(仪器)中称量。
(3)将称量好的NaOH固体放在500mL大烧杯中,倒入约100mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待______________后,将烧杯中的溶液注入容量瓶中;
(4)用少量蒸馏水洗涤烧杯________次,洗涤后的溶液_______________,轻轻晃动容量瓶,使溶液混合均匀;
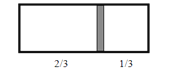
(5)向容量瓶中加入蒸馏水,到液面接近刻度线__________时,改用_________加蒸馏水至液面最低点与刻度线相切。盖好瓶塞,上下颠倒混合均匀;
(6)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是________,偏低的是________,对实验结果没有影响的是____________(填各选项的序号)。
A.所用的NaOH中混有少量Na2CO3
B.用带有生锈砝码的托盘天平称量一定质量固体NaOH
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线
【答案】500 8.0 小烧杯 冷却至室温 2—3 一起转入容量瓶 1—2cm 胶头滴管 BDF AEG C
【解析】
(1)依据溶液体积选择合适规格容量瓶;
(2)依据m=cVM计算需要溶质的质量;
(3)容量瓶不能用于盛放过冷或者过热的液体;,在室温下体积准确;
(4)为保证溶质全部转移的容量瓶中,移液后烧杯、玻璃棒应用蒸馏水洗涤,并将洗涤液转移到容量瓶;
(5)依据定容的正确操作解答;
(6)分析操作对溶质的物质的量和溶液体积的影响,依据c=![]() 解答。
解答。
(1)需用0.4molL-1NaOH溶液480mL,应选择500mL容量瓶,实际配制500mL溶液;
(2)配制0.4molL-1NaOH溶液480mL,实际配制500mL溶液,需要溶质的质量为:0.4mol/L×40g/mol×0.5L=8.0g;NaOH易潮解,且有强腐蚀性,应放在小烧杯中称量;
(3)将称量好的NaOH固体放在500mL大烧杯中,倒入约300mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待冷却到室温,将烧杯中的溶液注入容量瓶中;
(4)为保证溶质全部转移的容量瓶中,移液后烧杯、玻璃棒应用蒸馏水洗涤2-3次,并将洗涤液转移到容量瓶;
(5)定容的正确操作为:向容量瓶中加入蒸馏水,到液面离刻度线1-2cm 时,改用胶头滴管加蒸馏水至液面最低点与刻度线相切。盖好瓶塞,上下颠倒混合均匀;
(6)A.所用的NaOH中混有少量Na2CO3,导致溶质的物质的量偏小,溶液浓度偏低;
B.用带有生锈砝码的托盘天平称量一定质量固体NaOH,导致溶质的物质的量偏大,溶液浓度偏高;
C.配制溶液所用的容量瓶洗净后没有烘干,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变;
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作,冷却后溶液体积偏小,溶液浓度偏高;
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低;
F.定容时,俯视容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高;
G.定容摇匀静止后,发现液面低于刻度线,再加蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏低;
则:使所配制的NaOH溶液的浓度偏高的是BDF,偏低的是AEG,对实验结果没有影响的是C。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案