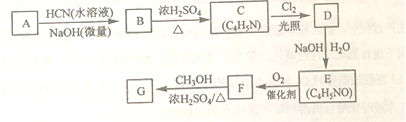
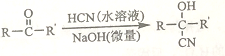
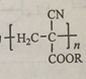题目内容
【题目】下列说法和解释错误的是
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物![]() 从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性。
【答案】A
【解析】
A.水分子间存在范德华力和氢键,冰融化时,需要破坏晶体中的范德华力和氢键,冰融化时密度变小,故A错误;
B.对于分子晶体来说,熔沸点高低取决于分子间的作用力范德华力,一般来说,对于组成和结构相似的分子,随分子量的增大,分子间力增大,其熔沸点升高,故B正确;
C.石墨晶体中层与层之间相隔340pm,距离较大,是以范德华力结合起来的,即层与层之间属于分子晶体,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向,故C正确;
D.金属内部有自由电子,当有外加电压时电子定向移动,因此金属可以导电,故D正确。
故选A。

【题目】探究溶液酸碱性对![]() 溶液的配制和保存的影响。10mL
溶液的配制和保存的影响。10mL![]() 或10mL
或10mL![]() 溶液中。
溶液中。
I.![]() 溶液的配制
溶液的配制
将![]() 分别溶于10mL蒸馏水或10mL
分别溶于10mL蒸馏水或10mL
溶液编号 | 溶剂 | 溶液性状 | |
① | 蒸馏水 | 浅黄色澄清溶液: | 遇 |
② |
| 无色澄清溶液: | 遇 |
③ |
| 无色澄清溶液 | 遇 |
(1)用平衡移动原理解释①显酸性的主要原因是________________
(2)②、③变红发生反应的离子方程式是_______________________
(3)甲同学认为①中一定有+3价铁。他用激光笔照射“溶液”,观察到光路:又向含有KSCN的①中滴入试剂a,溶液变红,说明其推断正确,试剂a是____________
II ![]() 溶液的保存
溶液的保存
将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
溶液编号 | 溶液性状 | |
① | 橙色浑浊 | 用 |
② | 无色溶液 | 滴加5滴 |
③ | 无色溶液 | 滴加5滴 |
(分析讨论)①②说明酸性减弱时,![]() 溶液更易变质;②③说明……
溶液更易变质;②③说明……
(查阅资料)在一定pH范围内,+2价铁的还原性随酸性减弱而增强,氧气的氧化性随酸性的增强而增强。
(进行实验)用右图所示装置完成实验(滴加试剂时溶液体积和溶液导电性变化可忽略)。向右池持续稳定通人氧气,待电流表示数稳定后:

I 向左池滴加浓硫酸至![]() 接近
接近![]() ,电流没有明显变化
,电流没有明显变化
II 向右池滴加等量浓硫酸,电流明显增大。
(4)补全(分析讨论):②③说明_______________
(5)ii中右池的电极反应方程式是____________________
(6)依据实验推断:③比②中![]() 更易变质的原因是___________________
更易变质的原因是___________________
(7)按上述原理及装置重新进行实验证实①中![]() 更易变质的原因。实验方案及预期现象是:向右池持续稳定通人氧气,待电流计示数稳定后,____________
更易变质的原因。实验方案及预期现象是:向右池持续稳定通人氧气,待电流计示数稳定后,____________
(8)依据实验,配制并保存![]() 溶液的最佳法是_________________。
溶液的最佳法是_________________。