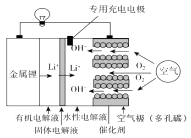
题目内容
【题目】环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.实验室常用铬酸氧化环己醇制备,但铬酸较贵且污染环境.某化学兴趣兴趣小组尝试用中学化学更常见的次氯酸钠代替铬酸制备环己酮.有关物质信息、实验流程如图1及实验装置如图2如下:环己酮:无色或浅黄色透明液体,有强烈的刺激性臭味,相对水的密度:0.95,熔点:﹣45℃,沸点:155℃,溶解度(100mL H2O):2.4g (31℃ ). 回答下列问题:
回答下列问题:
(1)仪器A的名称是 .
(2)在反应开始的5min,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有、 .
(3)加入饱和NaHSO3溶液时发生的主要反应是(用离子方程式表示),确保加入的饱和NaHSO3溶液已经足量的实验操作是 .
(4)为将馏出液的pH调至中性,可以加入的试剂是 .
A.稀盐酸
B.无水碳酸钠
C.浓硫酸
D.氢氧化钠固体
(5)调节pH后还需加入精制食盐,其目的是 , “取有机层”时使用的主要仪器是 . (填图3对应的字母).
(6)实验条件的优化对实验成败至关重要,小组成员觉得有必要对NaClO溶液的最佳浓度进行探究.他们配制了一系列不同浓度的NaClO溶液,并用滴定法标定.具体方法是:用移液管取10.00mL NaClO溶液于500mL容量瓶中定容,取25.00mL于锥形瓶中,加入适量稀盐酸和KI固体(足量),用0.1000mol/L Na2S2O3标准溶液滴定至终点(用淀粉溶液作指示剂),三次平行实验平均消耗Na2S2O3标准溶液18.00mL,已知I2+2Na2S2O3═2NaI+Na2S4O6 . 则该NaClO溶液的浓度是 .
【答案】
(1)三颈烧瓶
(2)搅拌器搅拌;缓慢滴加NaClO溶液
(3)ClO﹣+HSO3﹣═Cl﹣+H++SO42﹣;用玻璃棒蘸(或用毛细管吸)取反应液涂在碘化钾淀粉试纸上,若不显蓝色,则NaHSO3溶液已足量
(4)D
(5)降低环己酮的溶解度,有利于环己酮分层;c
(6)1.800mol/L
【解析】解:(1)由实验装置图可知,图2中仪器A的名称是三颈烧瓶,所以答案是:三颈烧瓶;(2)为了将体系温度维持在30~35℃,要不断搅拌加速热量传递,而且NaClO水解吸热,因此要缓慢滴加NaClO溶液,所以答案是:搅拌器搅拌;缓慢滴加NaClO溶液;(3)次氯酸根能将亚硫酸氢根氧化生成氯离子、硫酸根离子和氢离子,其离子方程式为:ClO﹣+HSO3﹣═Cl﹣+H++SO42﹣;已经足量时溶液中无次氯酸根,取反应液涂在碘化钾淀粉试纸上,若不显蓝色,则NaHSO3溶液已足量,所以答案是:ClO﹣+HSO3﹣═Cl﹣+H++SO42﹣;用玻璃棒蘸(或用毛细管吸)取反应液涂在碘化钾淀粉试纸上,若不显蓝色,则NaHSO3溶液已足量;(4)由(3)中分析可知溶液呈酸性,可加入无水碳酸钠或氢氧化钠固体,可以使溶液变为中性,所以答案是:BD;(5)环己酮在氯化钠中的溶解度较小,有利于环己酮分层;环己酮和水互不相溶,可用分液漏斗分离,所以选择的仪器为图3中的c,
所以答案是:降低环己酮的溶解度,有利于环己酮分层;c;(6)设NaClO溶液的浓度是x,
NaClO溶液中加入适量稀盐酸和KI固体(足量),发生的反应为:ClO﹣+2I﹣+2H+=Cl﹣+I2+H2O,再用0.1000mol/L Na2S2O3标准溶液滴定,发生的反应为:I2+2Na2S2O3═2NaI+Na2S4O6 ,
则 ClO﹣~I2 ~2Na2S2O3
1 2
10×10﹣3×x× ![]() 0.1000×18×10﹣3
0.1000×18×10﹣3
解得x=1.800mol/L,
所以答案是:1.800mol/L.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g)![]() CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
(1)已知: ![]() △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1
![]() △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式:________________
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:

①在上述三种温度中,曲线Z对应的温度是________________
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)![]() CH3OH(g)的平衡常数 K=_________。
CH3OH(g)的平衡常数 K=_________。
(3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度 (molL-1)变化如下表所示:
0min | 5min | 10min | |
CO | 0.1 | 0.05 | |
H2 | 0.2 | 0.2 | |
CH3OH | 0 | 0.04 | 0.05 |
若5min~10min只改变了某一条件,所改变的条件是_________________________。
【题目】某兴趣小组欲通过实验方法验证Fe2+的某些性质.
(1)在实验前,依据Fe2+的性,填写了如表.
实验操作 | 预期现象 | 反应的离子方程式 |
向盛有新割FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3﹣+2H+=Fe3++NO2↑+H2O |
依照表中操作,该小组进行实验.观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.
(2)分别取少量反应后的溶液于两只试管中,一只滴加几滴KSCN溶液,溶液变为变红,则溶液中含有;另一只试管滴加几滴溶液,产生蓝色沉淀,则含有Fe2+ .
(3)该小组讨论认为深棕色可能是NO2或NO与铁的某一种离子发生反应引起的.
提出猜想:
ⅰ.NO2与Fe2+发生反应ⅱ.NO2 与Fe3+发生反应
ⅲ.NO与Fe2+发生反应ⅳ.
(4)该小组用如图装置进行探究: 
步骤 | 操作及现象 | 解释或结论 |
① | 关闭k、b,打开a,开始甲中反应,一段时间后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化 | 溶液深棕色由与NO或NO2反应而的得到 |
② | 停止甲中反应,打开k、b,关闭a,持续通入N2一段时间 | 该操作的目的 |
③ | 更换新的丙、丁装置,再通一段时间N2后关闭k,使甲中反应继续,观察到的现象与步骤①中相同 | 乙瓶中发生的化学反应方程式为 |
(5)结合实验猜想,得出结论:
溶液呈深棕色的原因:肯定成立的是猜想;不确定的是猜想 , 有待后续实验进一步探究.