题目内容
【题目】苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸。反应原理如下:C6H5-CH3+2KMnO4![]() C6H5-COOK+KOH+2MnO2↓+H2O,C6H5-COOK+HCl→C6H5-COOH+KCl,已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3g和6.9g。
C6H5-COOK+KOH+2MnO2↓+H2O,C6H5-COOK+HCl→C6H5-COOH+KCl,已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3g和6.9g。
(制备产品)30.0mL甲苯和25.0mL1mol/L高锰酸钾溶液在80℃下反应30min,装置如图所示:
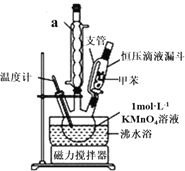
(1)仪器a的名称是___,图中支管的作用是______;
(2)相对于用酒精灯直接加热,用沸水浴加热的优点是_____,在本实验中,三颈烧瓶最合适的容积是___(填字母);
A.50mL B.100mL C.200mL D.250mL
(分离产品)他们设计如下流程分离粗产品苯甲酸和回收甲苯:

(3)操作Ⅰ的名称是____;含杂质的产物经操作Ⅱ进一步提纯得无色液体A,则操作Ⅱ的名称是_____;
(4)操作Ⅲ的名称是_____,固体B中可能会有________杂质离子,检验该离子的方法是_________;提纯B所用的方法是_________。
【答案】(球形)冷凝管 平衡压强,使甲苯顺利滴下 便于控制温度恒定和使容器受热均匀 B 分液 蒸馏 过滤 Cl- 取少量B溶于水,在上层清液中滴加稀硝酸酸化的AgNO3溶液,若产生白色沉淀,说明含有Cl- 重结晶
【解析】
(1)根据装置图像可知仪器a为球形冷凝管;恒压滴液漏斗的支管为使滴液漏斗液面压强与三颈烧瓶的压强相同;
(2)沸水浴加热的优点为加热均匀,且便于控制温度恒定;反应物总体积不超过容器的2/3;
(3)分离两种互不相溶的液体,为分液;利用沸点不同进行分离为蒸馏;
(4)水层中含有苯甲酸和氯化钾,采用冷却结晶、过滤的方式得到固体B;由于溶解度差距较大,可用重结晶进行提纯。
(1)根据装置图像可知仪器a为球形冷凝管;恒压滴液漏斗的支管为使滴液漏斗液面压强与三颈烧瓶的压强相同,使液体顺利流下;
(2)沸水浴加热的优点为加热均匀,且便于控制温度恒定;反应中加入30.0mL甲苯和25.0mL1mol/L高锰酸钾溶液,总体积不超过容器容积的2/3,则选用100mL,答案为B;
(3)分离有机层和水层两种互不相溶的液体常用分液法,则操作Ⅰ的名称为分液;有机层经干燥后,利用蒸馏的方法得到苯;
(4)水层中含有苯甲酸和氯化钾,采用冷却结晶、过滤的方法得到固体B,固体中可能含有K+、Cl-,可用硝酸银验证Cl-是否存在;由于两者溶解度差距较大,可用重结晶法进行提纯。

 名校课堂系列答案
名校课堂系列答案【题目】常温下,有关物质的溶度积如下
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
下列有关说法不正确的是( )
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg 2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg 2+)∶c(Fe3+)=2 .125×1021
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.054×10-2mol/L],若保持温度不变, 向其中加入100mL 0.012mol/L的NaOH,则该溶液变为不饱和溶液。



