题目内容
19.乙烯是重要的有机化工原料,利用乙烯进行如图转化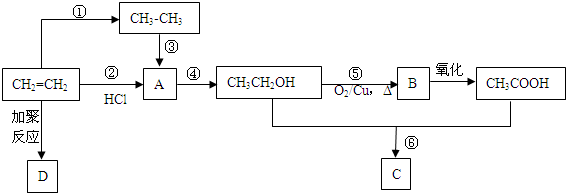
(1)乙醇分子中官能团的名称为羟基,D的结构简式为
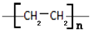 .
.(2)实验室中用于鉴别乙烯和乙烷的试剂可选用BD(填序号).
A.水 B.溴的四氯化碳溶液 C.氢气 D.酸性高锰酸钾溶液
(3)③的另一反应物及反应条件是氯气、光照;通过途径②、③均可得到A,其中属于加成反应的是②(填“②”或“③”).
(4)写出⑤、⑥的化学反应方程式:⑤2CH3CH2OH+O2→Cu△→Cu△2CH3CHO+2H2O、⑥CH3COOH+C2H5OH
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
分析 乙烯和氢气发生加成反应生成乙烷,乙烯发生加聚反应生成D,D为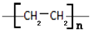 ;乙烯和HCl发生加成反应生成A,A为CH3CH2Cl,A发生水解反应生成乙醇,乙醇被催化氧化生成B,B为CH3CHO,乙醛被氧化生成乙酸,乙醇和乙酸发生酯化反应生成C,C为CH3COOCH2CH3,据此分析解答.
;乙烯和HCl发生加成反应生成A,A为CH3CH2Cl,A发生水解反应生成乙醇,乙醇被催化氧化生成B,B为CH3CHO,乙醛被氧化生成乙酸,乙醇和乙酸发生酯化反应生成C,C为CH3COOCH2CH3,据此分析解答.
解答 解:乙烯和氢气发生加成反应生成乙烷,乙烯发生加聚反应生成D,D为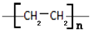 ;乙烯和HCl发生加成反应生成A,A为CH3CH2Cl,A发生水解反应生成乙醇,乙醇被催化氧化生成B,B为CH3CHO,乙醛被氧化生成乙酸,乙醇和乙酸发生酯化反应生成C,C为CH3COOCH2CH3,
;乙烯和HCl发生加成反应生成A,A为CH3CH2Cl,A发生水解反应生成乙醇,乙醇被催化氧化生成B,B为CH3CHO,乙醛被氧化生成乙酸,乙醇和乙酸发生酯化反应生成C,C为CH3COOCH2CH3,
(1)乙醇分子中官能团的名称为羟基,D的结构简式为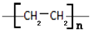 ,
,
故答案为:羟基;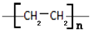 ;
;
(2)乙烯较活泼,乙烷较稳定,乙烯能和溴发生加成反应、能被酸性高锰酸钾溶液氧化,乙烷和溴、酸性高锰酸钾溶液都不反应,所以可以用溴的四氯化碳溶液、酸性高锰酸钾溶液鉴别乙烯和乙烷,故选BD;
(3)乙烷和氯气在光照条件下发生取代反应生成氯乙烷,所以③的另一反应物及反应条件是氯气、光照;通过途径②、③均可得到A,其中属于加成反应的是②,故答案为:氯气、光照;②;
(4)写出⑤、⑥的化学反应方程式分别为2CH3CH2OH+O2→Cu△→Cu△2CH3CHO+2H2O、CH3COOH+C2H5OH  CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:2CH3CH2OH+O2→Cu△→Cu△2CH3CHO+2H2O;CH3COOH+C2H5OH  CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
点评 本题考查有机物推断,涉及烯烃、烷烃、卤代烃、醇、醛、羧酸、酯之间的转化,根据反应条件结合物质性质分析解答,正确判断物质结构简式是解本题关键,题目难度不大.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
12.下列关于溶液中离子的说法不正确的是( )
| A. | 0.1mol•L-1的Na2CO3溶液中粒子浓度关系:c(Na+)═2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| B. | 常温下,氢氧化钠溶液中滴入醋酸使溶液的pH=7,则混合溶液中醋酸已过量 | |
| C. | 0.2mol•L-1的HCl和0.1 mol•L-1的NH3•H2O等体积混合后溶液中的离子浓度关系:c(Cl-)>c (NH4+)>c(H+)>c (OH-) | |
| D. | 0.1mol•L-1的NaHS溶液中离子浓度关系:c(S2-)+c(OH-)═c(H+)+c(H2S) |
10.下列化学用语表示正确的是( )
| A. | HClO的电子式为: | |
| B. | 硝基苯的结构简式为: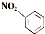 | |
| C. | 含18个中子的氯原子的核素符号:17351735Cl | |
| D. | 四氯化碳分子比例模型: |
7.下列说法正确的是( )
| A. | 25℃、101kPa下,1 g氢气燃烧生成液态水放出142.9 kJ热量,其热化学方程式为:2H2(g)+O2(g)═2H2O(l);△H=-285.8 kJ•mol-1 | |
| B. | 由水电离出的c(H+)=1×10-13mol/L的溶液中,CO32-、K+、SO42-、Cl-在溶液中可能大量存在 | |
| C. | 浓度均为0.lmol•L-1Na2CO3和NaHCO3混合液中:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 在反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,5molFeS2发生反应,有14mol电子发生转移 |
14.元素的性质呈周期性变化的根本原因是( )
| A. | 元素的相对原子质量的递增 | |
| B. | 元素的原子半径呈周期性变化 | |
| C. | 元素原子的最外层电子排布呈周期性变化 | |
| D. | 元素的金属性和非金属性呈周期性变化 |
11.下列关于化学键和晶体的说法正确的是( )
| A. | 离子晶体中只有离子键 | |
| B. | 非金属元素只能形成共价键 | |
| C. | 水分子中存在氢键,所以水的沸点较高 | |
| D. | 原子晶体的熔点不一定比金属晶体的熔点高 |
8.化学上常用燃烧法测定有机物的分子式,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成.下图所示的是用燃烧法确定有机物分子式的常用装置.

实验探究小组称取一定质量的样品(只含C、H、O三种元素中的两种或三种),进行实验,通过测定产生的CO2和水的质量确定有机物的组成,请回答下列问题:
(1)C管中浓硫酸的作用是除去氧气中的水蒸气,实验装置的连接顺序应是:D→C→E→B→A(每种装置只用一次);
(2)实验数据记录和处理
上表中①、②分别指哪个装置?B、A
(3)若实验准确称取4.4g样品,经燃烧后测得产生CO28.8g,水蒸气3.6g.要确定该有机物的分子式,还必须知道的数据是样品的摩尔质量;
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式CH3CHO,与该有机物相对分子质量相同的烃的一氯代物有2种.

实验探究小组称取一定质量的样品(只含C、H、O三种元素中的两种或三种),进行实验,通过测定产生的CO2和水的质量确定有机物的组成,请回答下列问题:
(1)C管中浓硫酸的作用是除去氧气中的水蒸气,实验装置的连接顺序应是:D→C→E→B→A(每种装置只用一次);
(2)实验数据记录和处理
| 物理量 实验序号 | 燃烧有机物的质量 | ① | ② | ||
| 实验前质量 | 实验后质量 | 实验前质量 | 实验后质量 | ||
| 1 | m1 | m2 | m3 | m4 | m5 |
(3)若实验准确称取4.4g样品,经燃烧后测得产生CO28.8g,水蒸气3.6g.要确定该有机物的分子式,还必须知道的数据是样品的摩尔质量;
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式CH3CHO,与该有机物相对分子质量相同的烃的一氯代物有2种.
9.下列离子方程式书写错误的是( )
| A. | H2O2和酸性氯化亚铁溶液反应:2Fe2++H2O2+2 H+═2Fe3++2H2O | |
| B. | 碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+2Ca2++4OH-═2CaCO3↓+Mg(OH)2↓+2H2O | |
| C. | 3 mol的Cl2通入含2 mol FeI2的溶液中:2Fe2++4I-+3Cl2═2Fe3++6Cl-+2I2 | |
| D. | 将SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O═CaSO3+2HClO |
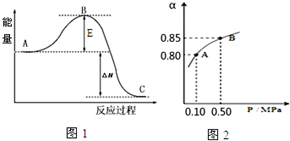 向某10L的恒温密闭容器中充入2molSO2和1molO2,2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图1所示.已知1mol SO2(g)氧化为1mol SO3放热99kJ,请回答:
向某10L的恒温密闭容器中充入2molSO2和1molO2,2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图1所示.已知1mol SO2(g)氧化为1mol SO3放热99kJ,请回答: