题目内容
7.下列说法正确的是( )| A. | 25℃、101kPa下,1 g氢气燃烧生成液态水放出142.9 kJ热量,其热化学方程式为:2H2(g)+O2(g)═2H2O(l);△H=-285.8 kJ•mol-1 | |
| B. | 由水电离出的c(H+)=1×10-13mol/L的溶液中,CO32-、K+、SO42-、Cl-在溶液中可能大量存在 | |
| C. | 浓度均为0.lmol•L-1Na2CO3和NaHCO3混合液中:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 在反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,5molFeS2发生反应,有14mol电子发生转移 |
分析 A、根据物质的物质的量与反应热成正比,计算1mol氢气燃烧生成液态水放热,结合热化学方程式的书写要求,标注物质聚集状态和对应反应的焓变得到;
B、水电离出的H+浓度c(H+)=10-13mol/L的溶液,为酸或碱溶液;
C、根据碳酸钠、碳酸氢钠混合液中的物料守恒判断;
D、14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,Cu元素的化合价由+2价降低为+1价,S元素的化合价由-1价降低为-2价,S元素的化合价由-1价升高为+6价.
解答 解:A、1gH2燃烧生成液态水时放出142.9kJ的热量,△H<0,1mol氢气燃烧生成液态水放热285.8 kJ,热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1,故A错误;
B、水电离出的H+浓度c(H+)=10-13mol/L的溶液,为酸或碱溶液,酸溶液中不能大量存在CO32-,碱溶液中可以共存,故B正确;
C、浓度均为0.1mol•L-1的Na2CO3、NaHCO3混合溶液,假设体积为1L,则n(Na+)=0.3mol,而c(CO32-)+c(HCO3-)+c(H2CO3)=0.2mol,则:2c(Na+)═3[c(CO32-)+c(H2CO3)+c(HCO3-)],故C错误;
D、5 mol FeS2发生反应,由S元素的化合价升高可知,有3mol×[6-(-1)]=21mol e-转移,故D错误;
故选B.
点评 本题考查了热化学方程式书写、溶液中离子浓度存在的物料守恒,影响水电离因素判断等知识,题目难度中等,注意掌握氧化还原反应电子转移的计算方法,学会利用电荷守恒、物料守恒、盐的水解原理结合溶液中的电离平衡的解决方法问题.

练习册系列答案
相关题目
20.下列关于有机物存在的叙述中,错误的是( )
| A. | 工业酒精中含有乙醇和甲醇 | B. | 在煤炭和石油中,苯的含量都较高 | ||
| C. | 许多水果中含有酯类化合物 | D. | 天然油脂中含有高级脂肪酸甘油酯 |
1.下述实验不能达到预期目的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 将少量氯水加入NaBr溶液中,并加适量CCl4振荡、静置 | 比较氯与溴单质的氧化性强弱 |
| B | 分别向2去试管中加入3ml,5%的H2O2溶液,一支放入5℃左右的冷水中,另一支放入40℃左右的热水中,观察 | 比较温度对化学反应速率的影响 |
| C | 向溶液中滴加盐酸酸化的氯化钡溶液 | 检验某溶液中是否一定含SO42- |
| D | 将实验室制得的CO2依次通过饱和NaHCO3溶液和浓硫酸 | 除去CO2中的HCl和H2O蒸气 |
| A. | A | B. | B | C. | C | D. | D |
15.下列变化中涉及化学变化的是( )
(1)爆竹燃放 (2)碘的升华
(3)金属钝化 (4)铝热反应
(5)干冰汽化(6)加热氯化铵
(7)甘油加水作护肤剂 (8)明矾净水
(9)蜂蚁螫咬后涂稀氨水可以减痛
(10)医用酒精可用于皮肤消毒
(11)烹鱼时加入少量的料酒和食醋可减少腥味
(12)橡胶老化 (13)用四氯化碳可擦去圆珠笔油渍
(14)蛋白质的盐析.
(1)爆竹燃放 (2)碘的升华
(3)金属钝化 (4)铝热反应
(5)干冰汽化(6)加热氯化铵
(7)甘油加水作护肤剂 (8)明矾净水
(9)蜂蚁螫咬后涂稀氨水可以减痛
(10)医用酒精可用于皮肤消毒
(11)烹鱼时加入少量的料酒和食醋可减少腥味
(12)橡胶老化 (13)用四氯化碳可擦去圆珠笔油渍
(14)蛋白质的盐析.
| A. | (1)(3)(4)(5)(7)(12)(13) | B. | (2)(4)(5)(7)(12)(13)(14) | ||
| C. | (2)(5)(7)(13)(14) | D. | 以上选项均不正确 |
2.硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)?[B(OH)4]-(aq)+H+(aq).下列说法正确的是( )
| 化学式 | 电离常数(298K) |
| 硼酸 | K=5.7×10-10 |
| 碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
| 醋酸 | K=1.75×10-5 |
| A. | 将一滴碳酸钠溶液滴入一硼酸溶液中一定能观察到有气泡产生 | |
| B. | 将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生 | |
| C. | 向0.2 mol•L-1 NaHCO3溶液中加入等体积的0.1 mol•L-1NaOH溶液:c(H2CO3)+c(H+)+c(HCO3-)=c(OH-)+c(CO32-) | |
| D. | 等物质的量浓度的碳酸溶液和醋酸溶液比较,pH:前者>后者 |
16.2006年10月29日,我国自主研发的通信广播卫星“鑫诺二号”发射成功.发射该卫星的“长征三号乙”运载火箭采用的是世界上最先进的液氢/液氧推进剂.现有氢气和氧气反应的两个热化学方程式:
①2H2(g)+O2(g)═2H2O(l);△H1=-571.6kJ•mol-1
②2H2(l)+O2(l)═2H2O(g);△H2=-482.6kJ•mol-1
则H2的燃烧热为( )
①2H2(g)+O2(g)═2H2O(l);△H1=-571.6kJ•mol-1
②2H2(l)+O2(l)═2H2O(g);△H2=-482.6kJ•mol-1
则H2的燃烧热为( )
| A. | 571.6 kJ•mol-1 | B. | 482.6 kJ•mol-1 | C. | 285.8 kJ•mol-1 | D. | 241.3 kJ•mol-1 |
17.乙烯酮(CH2=C=O)在一定条件下,能与含活泼氢的化合物发生如下反应,其反应可表示为:CH2=C=O+HA→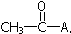 .下列各试剂,在一定条件下与乙烯酮发生反应,其产物不正确的是( )
.下列各试剂,在一定条件下与乙烯酮发生反应,其产物不正确的是( )
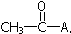 .下列各试剂,在一定条件下与乙烯酮发生反应,其产物不正确的是( )
.下列各试剂,在一定条件下与乙烯酮发生反应,其产物不正确的是( )| A. | HCl与之加成,生成CH3COCl | B. | CH3OH与之加成,生成CH3COCH2OH | ||
| C. | H2O与之加成,生成CH3COOH | D. | CH3COOH与之加成,生成 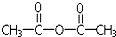 |
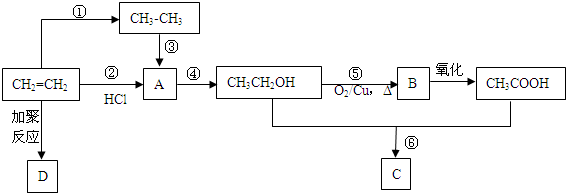
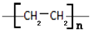 .
. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.