题目内容
4.己烷雌酚的一种合成路线如图:下列叙述正确的是( )
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件,化合物Y可与HCHO发生缩聚反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y中不含有手性碳原子 |
分析 A.X为卤代烃,在氢氧化钠水溶液中发生水解反应生成醇;
B.Y含有酚羟基,与苯酚性质相似;
C.Y含有酚羟基,可与氯化铁发生显色反应;
D.根据手性碳原子的定义判断.
解答 解:A.X为卤代烃,在氢氧化钠水溶液中发生水解反应生成醇,如发生消去反应,条件为氢氧化钠醇溶液,故A错误;
B.Y含有酚羟基,与苯酚性质相似,可与甲醛发生缩聚反应,故B正确;
C.Y含有酚羟基,可与氯化铁发生显色反应,故C正确;
D.连接四个不同的原子或原子团的碳原子为手性碳原子,Y中连接乙基的碳原子为手性碳原子,故D错误.
故选BC.
点评 本题为2015年江苏考题第12题,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,为解答该类题目的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列实验操作正确的是( )

| A. | 用玻璃棒蘸取CH3COOH溶液点在水湿润的pH试纸上,测定该溶液的pH | |
| B. | 中和滴定时,滴定管用所盛装的反应液润洗2~3次 | |
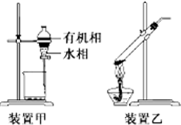
| C. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| D. | 用装置乙加热分解NaHCO3固体 |
7.关于氨水、氯水、双氧水和王水的说法,正确的是( )
| A. | 氨水能导电,说明氨气是电解质 | |
| B. | 新制的氯水中存在3 种分子,4 种离子 | |
| C. | 双氧水被称为“绿色氧化剂”其还原产物为O2 | |
| D. | 王水是浓盐酸和浓硝酸按体积比1:3 配成 |
4.下列转化及解释均正确的是( )
| 转化 | 解释 | |
| A | CuS+H2SO4=CuSO4+H2S↑ | 酸性:H2SO4>H2S |
| B | AgCl(s)+I-(aq)?AgI(s)+Cl-(aq) | Kap(AgCl)<Kap(AgI) |
| C | 2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;Fe+S$\frac{\underline{\;加热\;}}{\;}$FeS | 氧化性:Cl2>S |
| D | C(s,石墨)=C(s,金刚石)△H=+1.9kL/mol | 稳定性:石墨<金刚石 |
| A. | A | B. | B | C. | C | D. | D |
5.海洋是巨大的资源宝库,具有非常广阔的开发前景.
Ⅰ.从海水中提取食盐和溴的过程如下:
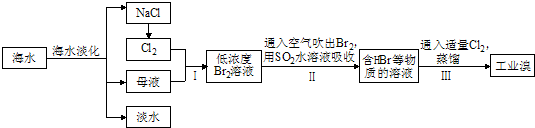
(1)请列举海水淡化的三种方法:蒸馏法、电渗析法、离子交换法.
(2)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质.某次除杂操作时,往粗盐水中先加入过量的BaCl2(填化学式),至沉淀不再产生后,继续加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去.经检测发现滤液中仍含有一定量的SO42-,已知Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=5.1×10-9,请分析滤液中仍含有SO42-的原因是:BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,BaSO4(s)会部分转化为BaCO3(s).将提纯后的NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、Cl2、NaOH或H2、NaClO.
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素.
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为:
Br2+SO2+2H2O═4H++SO42-+2Br-,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀.
Ⅱ.按以下实验方案可从海洋动物炳海鞘中提取具有抗肿瘤活性的天然产物.
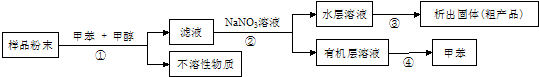
(5)下列叙述正确的是a、b、d(填序号).
a.步骤①需要过滤装置 b.步骤②需要用到分液漏斗
c.步骤③需要用到坩埚 d.步骤④需要蒸馏装置
Ⅲ.海水淡化后剩余的浓海水经过一系列工艺流程可以获取其他产品,如Mg(OH)2等.浓海水的主要成分如下:
(6)理论上,1L浓海水最多可得到Mg(OH)2的质量为69.6 g.
Ⅰ.从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的三种方法:蒸馏法、电渗析法、离子交换法.
(2)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质.某次除杂操作时,往粗盐水中先加入过量的BaCl2(填化学式),至沉淀不再产生后,继续加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去.经检测发现滤液中仍含有一定量的SO42-,已知Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=5.1×10-9,请分析滤液中仍含有SO42-的原因是:BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,BaSO4(s)会部分转化为BaCO3(s).将提纯后的NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、Cl2、NaOH或H2、NaClO.
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素.
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为:
Br2+SO2+2H2O═4H++SO42-+2Br-,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀.
Ⅱ.按以下实验方案可从海洋动物炳海鞘中提取具有抗肿瘤活性的天然产物.

(5)下列叙述正确的是a、b、d(填序号).
a.步骤①需要过滤装置 b.步骤②需要用到分液漏斗
c.步骤③需要用到坩埚 d.步骤④需要蒸馏装置
Ⅲ.海水淡化后剩余的浓海水经过一系列工艺流程可以获取其他产品,如Mg(OH)2等.浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
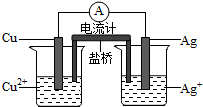 银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照相器材等领域亦有广泛应用.回答下列问题:
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照相器材等领域亦有广泛应用.回答下列问题: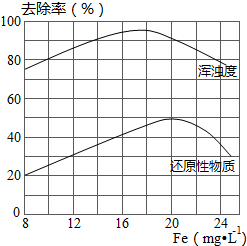 FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小,请回答下列问题:
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小,请回答下列问题: 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表).其实验步骤为:
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表).其实验步骤为: