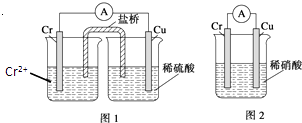
题目内容
【题目】室温下,用0.1000mol/L盐酸分别滴定20.00mL浓度均为0.1000mol/L氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积V[HCl(aq)]的变化关系如图所示。下列说法正确的是

A. Ⅰ表示是滴定氨水的曲线,V[HCl(aq)]=20mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B. pH=7时,两种溶液中:c(Na+)=c(NH4+)
C. 滴定氢氧化钠溶液,V[HCl(aq)]>20mL时可能有c(Cl-)>c(Na+)>c(H+)>c(OH-)
D. 消定氨水时,当V[HCl(aq)]=10mL时,有2[c(OH-)-c(H+)]=c(NH4+)-c(NH3·H2O)
【答案】B
【解析】A、0.1000mol/L氢氧化钠溶液pH=13,氨水部分电离溶液pH<13,A错误。B、根据溶液中离子电荷守恒,当溶液pH=7时,HCl与NaOH混合溶液中c(Na+)+c(H+)=c(Cl -)+c(OH-),则c(Na+)=c(Cl -);HCl与氨水混合溶液中c(NH4+)+c(H+)=c(Cl -)+c(OH-),则c(NH4+)=c(Cl -),所以两种溶液中c(Na+)=c(NH4+),B正确。C、滴定NaOH溶液盐酸消耗20mL时,溶液中恰好生成NaCl,此时溶液中c(Na+)= c(Cl -)> c(H+)=c(OH-),所以当V[HCl(aq)]>20mL时,溶液中c(Cl-)>c(Na+)>c(H+)>c(OH-),当盐酸足够多时,c(Cl-)> >c(H+) c(Na+)>c(OH-),C正确。D、滴定氨水中的盐酸为10mL时,溶液中溶质为NH3H2O和NH4Cl且物质的量之比为1:1,则根据溶液中离子电荷守恒得c(NH4+)+c(H+)=c(Cl -)+c(OH-),Cl元素与N元素原子数之比为1:2,既2c(Cl -)=c(NH4+)+c(NH3H2O),约去Cl-得2[c(OH-)-c(H+)]=c(NH4+)-c(NH3·H2O),D 正确。正确答案B。

【题目】已知某条件下,合成氨反应的数据如下:N2(g)+3H2(g)2ΝΗ3(γ)
起始浓度/molL﹣1 | 1.0 | 3.0 | 0.2 |
2s末浓度/molL﹣1 | 0.6 | 1.8 | 1.0 |
4s末浓度/molL﹣1 | 0.4 | 1.2 | 1.4 |
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是( )
A.2s末氨气的反应速率=0.4mol(Ls)﹣1
B.前2s时间内氨气的平均反应速率=0.4mol(Ls)﹣1
C.前4s时间内氨气的平均反应速率=0.3mol(Ls)﹣1
D.2~4s时间内氨气的平均反应速率=0.2mol(Ls)﹣1