��Ŀ����
����Ŀ��������������Խ������Ϊ��Fe��Al��Ӧ�ù㷺����������������
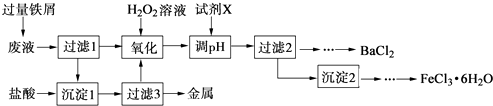
��1��Ti��̬ԭ�ӵļ۲�����Ų�ͼΪ_______________________��
��2��������B��C��N��O�ȷǽ���Ԫ���γ��ȶ��Ļ�����縺�ԣ�C________(��������������������ͬ)B����һ�����ܣ�N________O��ԭ����____________________________________��
��3��������ʯ���������ҵ���Ҫ�ɷ�Ϊ��������(FeTiO3)��FeTiO3��80%�����ᷴӦ������TiOSO4��SO42-�Ŀռ乹��Ϊ_________�Σ�������ԭ�Ӳ���_________�ӻ���д��SO42-��һ�ֵȵ�����Ļ�ѧʽ��____________________________��
��4��Ti���������CaO��������γ�������CaTiO3��CaTiO3�ľ���ṹ��ͼ1��ʾ(Ti4��λ��������Ķ���)���þ����У�Ti4+����Χ________��O2-����ڡ�

��5���������Ľṹ��ͼ2��ʾ����������߳�Ϊa����ԭ�Ӱ뾶Ϊr����þ�������ԭ�ӵĿռ�������Ϊ________________��
���𰸡� 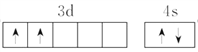 �� �� Nԭ���е�2p������ڰ����״̬�����ȶ� �������� sp3 ClO4-�� 12
�� �� Nԭ���е�2p������ڰ����״̬�����ȶ� �������� sp3 ClO4-�� 12 ![]()
����������1��TiΪ22��Ԫ�أ���ԭ�ӵĻ�̬�����Ų�ʽΪ[Ar]3d24s2��������۵����Ų�ͼΪ ��
��
��2��ͬ����Ԫ�ش������ҵ縺������������C����B��N��2p�ܼ�����3�����ӣ�ǡ������������ȶ��ṹ������ʹN�ĵ�һ�����ܷ�������ʹ��һ������N����O��
��3�����ݼ۲���ӶԻ������ۣ���������ӵ�����ԭ�ӣ�S���������6�����ӣ���λ��O���ṩ���ӣ����Ǵ���2�����磬�����������8�����ӣ��൱��4�����Ӷԡ��ռ乹��Ϊ�������壬����ԭ��S��sp3�ӻ�����ȵ�������Ӧ��ѡ��ԭ������ͬ����������ȵ����������Կ�����ClO4-��PO43-����
��4��Ti4+λ��������Ķ�����������8��1/8=1�������ݻ�ѧʽ�õ������е�Ca2+ҲӦ����1����������λ�ھ��������ģ���ôO2-һ��λ�ھ��������ġ���ͼ1�õ�����Ti4+���ڵ�O2-Ӧ���Ǹþ��������ġ����ǿ��Խ���������ƽ�ƣ�����ƽ�ƺ��µľ����У�Ca2+λ�ڶ��������ʱTi4+λ��������O2-λ����������Ti4+����Χ12����������ϵ�12��O2-����ڡ�
��5����ͼ2�������߳�Ϊa������Խ��߳�Ϊ![]() ����Ϊ��Խ����ϵ�����ԭ������������
����Ϊ��Խ����ϵ�����ԭ������������![]() ����
����![]() ����������������ԭ����8��1/8+1��1=2���������Ϊ
����������������ԭ����8��1/8+1��1=2���������Ϊ![]() ���������Ϊa3�����Կռ�������Ϊ
���������Ϊa3�����Կռ�������Ϊ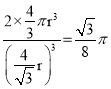 ��
��

 100�ִ�����ĩ���ϵ�д�
100�ִ�����ĩ���ϵ�д� ��У���˿��ֿ���ϵ�д�
��У���˿��ֿ���ϵ�д�����Ŀ��������һ����Ҫ�Ļ�����Ʒ����������Ρ����ص�ԭ�ϣ���ҵ�ϳɰ��ķ�Ӧ���£� N2��g��+3H2��g��2NH3��g����H=һ92.4KJmol��1
��1����֪H2��g����ȼ����Ϊ285KJ/mol��д��NH3��g���ڴ�����ȼ���������������ʵ��Ȼ�ѧ����ʽ��
��2��25��ʱ����a mol ��NH4��2SO4����ˮ�������Һ�еμ�V Lϡ��ˮ����Һ�����ԣ���μӰ�ˮ�Ĺ�����ˮ�ĵ���ƽ�⽫��������������������ƶ������μ�ϡ��ˮ�����ʵ���Ũ��ΪmolL��1 �� ��25��ʱ��NH3H2O�ĵ���ƽ�ⳣ��Kb��2��10��5��
��3����ҵ�ϳ�ͨ�����·�Ӧ�ϳ�����[CO��NH2��2]�� CO2��g��+2NH3��g��CO��NH2��2��l��+H2O��g����H��0��t��ʱ�����ݻ��㶨Ϊ2L���ܱ������м���0.10molCO2��0.40molNH3 �� ��Ӧ��CO2�� g�������ʵ�����ʱ��仯�����ʾ��
ʱ��/min | ��0 | 30 | 70 | 80 | 100 |
n��CO2��/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
��20minʱ��������CO2 ��80minʱ�����棨H2O�������������=������������t��ʱ���÷�Ӧ��ƽ�ⳣ������ʽΪK=��
����100minʱ�����������������䣬���������г���0.050mo1CO2��0.20molNH3 �� ���½���ƽ���CO2��ת������ԭƽ����Ƚ�������������䡱��С������
���������淴Ӧ��ƽ�ⳣ��Ϊ��������λС������
�ܸ��ݱ���������ͼ���л��Ƴ���t����NH3��ת������ʱ��仯��ͼ���������������䣻��t+10��������ȷ��ͼ�����������ͼ���еġ�A����B������ 
��ͼ����ʾװ�ã�����������Ϊ���Ե缫�������ڵ�����ء�CO��NH2��2���ļ�����Һ��ȡ��������װ���������ĵ缫��ӦʽΪ �� ���������ռ�������22.4L��������������ĵ�����Ϊg������������ܽ⣩��