题目内容
【题目】金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4). 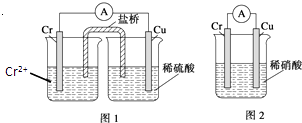
(1)铜铬构成原电池如图1,其中盛稀硫酸烧杯中的现象为: . 盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是: A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液
B.理论上1molCr溶解,盐桥中将有2molCl﹣进入左池,2molK+进入右池
C.此过程中H+得电子,发生氧化反应
D.电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中
(2)如构成图2电池发现,铜电极上不再有图1的现象,铬电极上产生大量气泡,遇空气呈红棕色.写出正极电极反应式: .
(3)某同学把已去掉氧化膜的铬片直接投入氯化铜溶液时,观察到了预料之外的现象:①铬片表面上的铜没有紧密吸附在铬片的表面而是呈蓬松的海绵状;②反应一段时间后有大量气泡逸出,且在一段时间内气泡越来越快,经点燃能发出爆鸣声,证明是氢气.请解释这两种现象的原因 .
【答案】
(1)铜电极上有气泡产生; B
(2)4H++NO3﹣+3e﹣=NO↑+2H2O
(3)铜离子水解使溶液显酸性,氢离子与Cr反应生成氢气,气泡使铜疏松;形成了铬铜原电池,加快了反应速率,所以产生气体气体速率加快.
【解析】解:(1)铬能与稀硫酸反应生成氢气,盛稀硫酸烧杯中在铜电极上有气泡产生;
A、盐桥中不是都可以用饱和KCl琼脂溶液,若电解质溶液为硝酸银溶液时,会生成沉淀,故A错误;
B、1molCr反应,转移2mol电子,为保持电荷守恒,盐桥中将有2molCl﹣进入左池,2molK+进入右池,故B正确;
C、氢离子得电子发生还原反应,故C错误;
D、盐桥中是离子移动,无电子通过,故D错误;
所以答案是:铜电极上有气泡产生;B;(2)正极上是硝酸根离子得电子生成NO,有氢离子参与反应,电极反应式为:4H++NO3﹣+3e﹣=NO↑+2H2O,所以答案是:4H++NO3﹣+3e﹣=NO↑+2H2O;(3)①硫酸铜溶液中因为铜离子水解使溶液显酸性,氢离子与Cr反应生成氢气,气泡使铜疏松;Cr能够与硫酸铜溶液反应置换出Cu,形成了铬铜原电池,加快了反应速率,所以产生气体越来越快,
所以答案是:铜离子水解使溶液显酸性,氢离子与Cr反应生成氢气,气泡使铜疏松;形成了铬铜原电池,加快了反应速率,所以产生气体气体速率加快.