题目内容
【题目】A.依据氧化还原反应:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s)设计的原电池如图所示。

请回答下列问题:
(1)电极X的材料是____________,电解质溶液是_____________。
(2)Y电极发生的电极反应为______________________________。
(3)若开始时X、Y为质量相等的电极,当两极质量差为14克时,转移的电子数为_______。
B.燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内部的新型发电装置,是一种具有应用前景的绿色电源。下图为碱性甲烷燃料电池原理示意图:

总反应:CH4 + 2O2+ 2OH-=CO2-3 + 3H2O
正极:4H2O + 2O2 + 8e- = 8OH-
按照此图的提示回答下列问题:
(1)该燃料电池的负极是______(填“a”或“b”),b电极发生_______反应(填氧化或还原)。
(2)在正极附近溶液的碱性________(填“增强”或“减弱”)。
(3)a电极的电极方程式为________________。
【答案】 Cu AgNO3 Ag++e-=Ag 0.1NA a 还原反应 增强 CH4 -8e-+ 10OH- = CO32- + 7H2O
【解析】A.根据反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”分析,在反应中,Cu被氧化,失电子,应为原电池的负极,电极反应为Cu-2e-=Cu2+,则正极为活泼性较Cu弱的Ag或者惰性电极,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,电解质溶液为AgNO3,原电池中,电子从负极经外电路流向正极,根据得失电子数相等计算。
B.根据甲烷在碱性条件下的总反应:CH4 + 2O2+ 2OH- = CO32- + 3H2O, CH4失去电子,被氧化,在负极反应,O2得到电子,被还原,在正极发生反应。
A.根据电池反应式知,铜失电子作负极,结合图片可知,银作正极,(1)铜作负极,银作正极,所以X是铜,银电极所在的电解质溶液为可溶性的银盐溶液,所以Y溶液是硝酸银溶液,正确答案为:铜;AgNO3溶液;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e-=Ag,
正确答案为: Ag++e-=Ag;
(3)X(Cu)电极溶解,质量减少,Y(Ag)电极Ag+得电子生成Ag析出,设负极Cu减少xmol,根据电子守恒,正极析出的Ag为2xmol,因为开始时X、Y为质量相等,反应后两极质量差为14克,则108g/mol×2Xmol+64g/mol×Xmol=14g,X=0.05mol,失去的电子数为0.05mol×2NA=0.1NA,正确答案0.1NA。
B.(1)甲烷在碱性条件下的总反应:CH4 + 2O2+ 2OH- = CO32- + 3H2O, CH4碳元素化合价升高,失去电子, a电极是负极,O2得到电子,b电极是正极,被还原,发生还原反应;正确答案:a;还原;
(2)正极发生的电极反应式:4H2O + 2O2 + 8e- = 8OH-,有OH-生成,所以在正极附近溶液的碱性增强;正确答案:增强;
(3)根据分析,a电极是负极,CH4在碱性条件下失去电子的反应,其电极反应式:CH4 -8e-+ 10OH- = CO-32 + 7H2O,正确答案:CH4 -8e-+ 10OH- = CO32- + 7H2O。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A= , C= , E=
实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
① | 常温 | 1 | 20 | 50 | 30 | t1 |
② | 常温 | A | B | C | 30 | t2 |
③ | 常温 | 2 | 40 | D | E | t3 |
(2)该反应的离子方程式 .
(3)若t1<t2 , 则根据实验①和②得到的结论是 .
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是: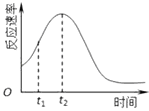
①;② .
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O42H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:;实验中所需的定量仪器有(填仪器名称).该KMnO4溶液的物质的量浓度为mol/L.