题目内容
【题目】已知![]() (x)、
(x)、![]() (y)、
(y)、![]() (z) 互为同分异构体,下列说法不正确的是( )
(z) 互为同分异构体,下列说法不正确的是( )
A. Z的二氯代物只有三种
B. x、y、z中只有x的所有原了可能处于同一平面
C. x、y可使溴的四氯化碳溶液因发生加成反应而褪色
D. x的同分异构体只有y和z两种
【答案】D
【解析】A、立方烷Z的二氯代物的同分异构体分别是:一条棱、面对角线、体对角线上的两个氢原子被氯原子代替,所以二氯代物的同分异构体有3种,选项A正确;B、苯的12个原子在同一平面,乙烯的6个原子在同一平面上,若x (苯乙烯)两个面旋转到同一面,则所有原子在同一平面上,而y、z分子中均存在烷或环烷的结构,根据甲烷正四面体结构特点,两者的所有原子不可能处于同一平面,选项B正确;C、x、y中均含有碳碳双键盘,均可使溴的四氯化碳溶液因发生加成反应而褪色,选项C正确;D、x的同分异构体除了y和z两种外,还可以有CH![]() C-CH2CH=CHCH2C
C-CH2CH=CHCH2C![]() CH等,选项D不正确。答案选D。
CH等,选项D不正确。答案选D。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】氨气是一种重要的化工产品,是生产铵盐、尿素等原料,工业合成氨的反应如下: N2(g)+3H2(g)2NH3(g)△H=一92.4KJmol﹣1
(1)已知H2(g)的燃烧热为285KJ/mol,写出NH3(g)在纯氧中燃烧生成无毒、无害物质的热化学方程式.
(2)25℃时,将a mol (NH4)2SO4溶于水,向该溶液中滴加V L稀氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将(填“正向”、“不”或“逆向”)移动,所滴加稀氨水的物质的量浓度为molL﹣1 . (25℃时,NH3H2O的电离平衡常数Kb≈2×10﹣5)
(3)工业上常通过如下反应合成尿素[CO(NH2)2]: CO2(g)+2NH3(g)CO(NH2)2(l)+H2O(g)△H<0,t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3 . 反应中CO2( g)的物质的量随时间变化如表所示:
时间/min | 0 | 30 | 70 | 80 | 100 |
n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
①20min时,υ正(CO2 )80min时.υ逆(H2O)(填“>”、“=”或“<”).在t℃时,该反应额平衡常数表达式为K=;
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3 , 重新建立平衡后CO2的转化率与原平衡相比将(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为(保留二位小数).
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象;保持其它条件不变;则(t+10)℃下正确的图象可能是(填图甲中的“A”或“B”). 
⑤图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气.该装置中阳极的电极反应式为 , 若两极共收集到气体22.4L(标况),则消耗的尿素为g(忽略气体的溶解).
【题目】已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A= , C= , E=
实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
① | 常温 | 1 | 20 | 50 | 30 | t1 |
② | 常温 | A | B | C | 30 | t2 |
③ | 常温 | 2 | 40 | D | E | t3 |
(2)该反应的离子方程式 .
(3)若t1<t2 , 则根据实验①和②得到的结论是 .
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是: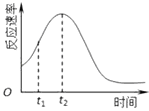
①;② .
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O42H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:;实验中所需的定量仪器有(填仪器名称).该KMnO4溶液的物质的量浓度为mol/L.