题目内容
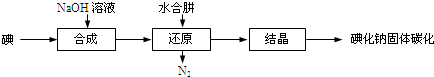
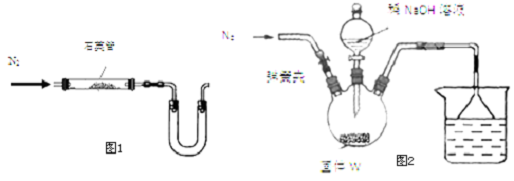
12.曾经有一种固氮的方法:1100°C通N2和CaC2反应得到CaCN2.已知:CaCN2+3H2O=2NH3↑+CaCO3↓(1)某同学采用图1装置(加热和夹持仪器已略去)制取少量的CaCN2
①U形管中盛放的物质是碱石灰或无水氯化钙等(填一种),其作用是:防止空气中的水进入石英管影响实验
②不能(填“能”或“不能”)用普通玻璃管代替图中石英管;
(2)检验反应后的固体(用W表示)中含有氮元素该同学将适量W溶于水,有气泡产生,说明固体中含有氮元素,该结论不正确.若要得出正确结论,还需进行的实验是将湿润的红色石蕊试纸置于容器口,试纸变蓝色,说明固体中含有氮元素.
(3)测定W中CaCN2的质量分数
步骤Ⅰ:按图2所示装置(夹持仪器已略去)进行实验:关闭弹簧夹,将漏斗中溶液逐滴加入到三颈瓶中,当W反应完全后,打开弹簧夹,通入氮气,直至氨气被200mL0.1mol•L-1硫酸完全吸收.
步骤Ⅱ:准确量取烧杯中溶液20.00mL置于锥形瓶中,滴入几滴指示剂,用cmol•L-1NaOH溶液滴定过量的硫酸,实验测得消耗标准溶液的平均体积为vmL.
已知三种常用指示剂变色pH范围如下:
| 指示剂 | a | b | c |
| 变色pH范围 | 3.1~4.4 | 8.0~10.0 | 4.4~6.2 |
| 说明 | pH<3.1显红色 pH>4.4显黄色 | pH<8.0显无色 pH>10.0显红色 | pH<4.4显红色 pH>6.2显黄色 |
②三颈瓶中除了发生生成氨气的反应,还有:CaC2+2H2O=C2H2↑+Ca(OH)2(用化学方程式表示),烧杯中最终吸收氨气的物质的量为0.04-0.01cvmol;经进一步计算可求得W中CaCN2质量分数.
③上述实验所得结果明显偏小,若不考虑装置的气密性和操作误差,则导致结果偏小的可能原因是步骤Ⅰ中未加热反应容器或生成碳酸钙覆盖在固体表面,导致反应不完全(写1种).
分析 (1)①由于碳化钙极易与水反应,因此U形管中有关盛放固体干燥剂防止水蒸气进入,因此可以是碱石灰或无水氯化钙等;
②由于普通玻璃中含有二氧化硅,而在高温下二氧化硅能与碳酸钙反应生成硅酸钙和CO2,所以不能用普通玻璃管代替图中石英管;
(2)由于过量的碳化钙也能与水反应产生气泡,因此要验证含有氮元素,还必须检验生成的气体中含有氨气,所以正确的操作是将湿润的红色石蕊试纸置于容器口,试纸变蓝色,说明固体中含有氮元素;
(3)①滴定前溶液显酸性,而b指示剂在酸性条件下是无色的,当硫酸恰好被反应后,硫酸铵溶液还是显酸性的,因此如果用b指示剂,溶液仍然是无色的,因此不宜选用的是b;
②样品中有碳化钙,碳化钙能与水反应生成乙炔和氢氧化钙,消耗氢氧化钠的物质的量是0.001cvmol,则根据反应式2NaOH+H2SO4=Na2SO4+2H2O可知剩余硫酸的物质的量是0.0005cvmol×$\frac{200mL}{20mL}$=0.005cvmol,所以与氨气反应的硫酸的物质的量是0.02mol-0.005cvmol,则与硫酸反应的氨气的物质的量是(0.02mol-0.005cvmol)×2=(0.04-0.01cv)mol;
③由于反应需要加热且反应中有碳酸钙生成,因此如果实验所得结果明显偏小,则可能的原因是步骤Ⅰ中未加热反应容器或生成碳酸钙覆盖在固体表面,导致反应不完全.
解答 解:(1)①由于碳化钙极易与水反应,因此U形管中有关盛放固体干燥剂防止水蒸气进入,因此可以是碱石灰或无水氯化钙等;
故答案为:碱石灰或无水氯化钙等;防止空气中的水进入石英管影响实验;
②由于普通玻璃中含有二氧化硅,而在高温下二氧化硅能与碳酸钙反应生成硅酸钙和CO2,所以不能用普通玻璃管代替图中石英管;
故答案为:不能;
(2)由于过量的碳化钙也能与水反应产生气泡,因此要验证含有氮元素,还必须检验生成的气体中含有氨气,所以正确的操作是将湿润的红色石蕊试纸置于容器口,试纸变蓝色,说明固体中含有氮元素;
故答案为:将湿润的红色石蕊试纸置于容器口,试纸变蓝色,说明固体中含有氮元素;
(3)①滴定前溶液显酸性,而b指示剂在酸性条件下是无色的,当硫酸恰好被反应后,硫酸铵溶液还是显酸性的,因此如果用b指示剂,溶液仍然是无色的,因此不宜选用的是b;
故答案为:b;
②样品中有碳化钙,碳化钙能与水反应生成乙炔和氢氧化钙,反应方程式为CaC2+2H2O=C2H2↑+Ca(OH)2,消耗氢氧化钠的物质的量是0.001cvmol,则根据反应式2NaOH+H2SO4=Na2SO4+2H2O可知剩余硫酸的物质的量是0.0005cvmol×$\frac{200mL}{20mL}$=0.005cvmol,所以与氨气反应的硫酸的物质的量是0.02mol-0.005cvmol,则与硫酸反应的氨气的物质的量是(0.02mol-0.005cvmol)×2=(0.04-0.01cv)mol;
故答案为:CaC2+2H2O=C2H2↑+Ca(OH)2;0.04-0.01cv;
③由于反应需要加热且反应中有碳酸钙生成,因此如果实验所得结果明显偏小,则可能的原因是步骤Ⅰ中未加热反应容器或生成碳酸钙覆盖在固体表面,导致反应不完全;
故答案为:步骤Ⅰ中未加热反应容器或生成碳酸钙覆盖在固体表面,导致反应不完全.
点评 本题考查氮的固定,涉及实验方案的设计、滴定原理的应用、质量分数的测定,较为综合,难度较大,弄清实验原理是解题的关键.

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案| A. |  稀硫酸 | B. |  稀硫酸 | C. |  硫酸铜溶液 | D. |  乙醇溶液 |
| A. | v1=v2 | B. | v1=2v3 | C. | v3=3v2 | D. | v1=v4 |
Ⅰ.【查阅资料】
(1)连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
(2)2Na2S2O4+4HCl=4NaCl+S↓+3SO2↑+2H2O;Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O.
Ⅱ.【制备方法】
75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:
HCOONa+1Na2CO3+4SO2□=2Na2S2O4+3CO2+□
冷却至40~50℃,过滤,用乙醇洗涤,干燥制得Na2S2O4.
Ⅲ.【Na2S2O4的性质】
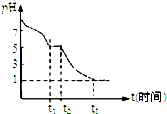
(1)Na2S2O4溶液在空气中易被氧化.课题小组测定0.050mol/LNa2S2O4溶液在空气中pH变化如图所示:0~t1段主要先生成HSO3-,0~t1段发生反应的离子反应方程式为2S2O42-+O2+2H2O=4HSO3-.
t3时溶液中主要阴离子是SO42-.
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体为SO2(填化学式).
请你设计实验验证产物有Na2S2O3存在,完成下表中内容.
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取少量完全分解的固体产物于试管中,加入稀盐酸 | 若有淡黄色沉淀,则有Na2S2O3存在 |
| A. | 若仅加入催化剂,改变反应途径→降低反应所需要的活化能→活化分子数增多→有效碰撞次数增多→化学反应速率增大 | |
| B. | 若仅增大反应物浓度,单位体积活化分子数增多→单位体积有效碰撞次数增多→化学反应速率增大 | |
| C. | 若仅升高温度,活化分子百分数增加且分子间的碰撞频率提高→有效碰撞次数增多→化学反应速率增大 | |
| D. | 若仅加大体系压强,体积变小→活化分子百分数增加→单位体积的活化分子数目增加→有效碰撞次数增多→化学反应速率增大 |
| A. | CO2 | B. | 氯水 | C. | 水蒸气 | D. | 氯化钠溶液 |