题目内容
19.在化学反应 A(g)+3B(g)?2C (g)+D(g)中,A、B、C、D的平均反应速率分别为v1、v2、v3、v4,则下列关系正确的是( )| A. | v1=v2 | B. | v1=2v3 | C. | v3=3v2 | D. | v1=v4 |
分析 化学反应速率之比等于化学计量数之比,以此来解答.
解答 解:A.A、B的化学计量数之比为1:3,则3v1=v2,故A错误;
B.A、C的化学计量数之比为1:2,则2v1=v3,故B错误;
C.B、C的化学计量数之比为3:2,则3v3=2v2,故C错误;
D.A、D的化学计量数之比为1:1,则v1=v4,故D正确;
故选D.
点评 本题考查化学反应速率的关系,为高频考点,把握化学反应速率与化学计量数的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
9.下列溶液一定呈中性的是( )
| A. | 加甲基橙呈黄色的溶液 | B. | pH=7 的溶液 | ||
| C. | c(H+)=10-14mol/L的溶液 | D. | c(OH-)=$\sqrt{Kw}$ 的溶液 |
10.下列有关物质用途的说法中,不正确的是( )
| A. | 氨可用作致冷剂 | |
| B. | 漂白粉可用作环境的消毒剂 | |
| C. | 铝制容器常温下可盛装浓硝酸 | |
| D. | 二氧化硅是将太阳能转化为电能的常用材料 |
7.下列表示物质结构的化学用语或模型正确的是( )
| A. | 二氧化碳的结构式: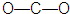 | B. | HF的电子式: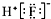 | ||
| C. | Cl-的结构示意图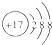 | D. | CH4分子的球棍模型: |
11.下列说法中正确的是( )
| A. | 标准状况下,22.4L水中所含的分子数约为6.02×1023个 | |
| B. | 1 mol Cl2参加反应转移电子数一定为2 NA个 | |
| C. | 48gO3与O2的混合气体中含有的氧原子数为3NA 个 | |
| D. | 从1L0.5 mol/LNaCl溶液中取出100mL,剩余溶液中NaCl物质的量浓度为0.45mol/L |
12.曾经有一种固氮的方法:1100°C通N2和CaC2反应得到CaCN2.已知:CaCN2+3H2O=2NH3↑+CaCO3↓
(1)某同学采用图1装置(加热和夹持仪器已略去)制取少量的CaCN2
①U形管中盛放的物质是碱石灰或无水氯化钙等(填一种),其作用是:防止空气中的水进入石英管影响实验
②不能(填“能”或“不能”)用普通玻璃管代替图中石英管;
(2)检验反应后的固体(用W表示)中含有氮元素该同学将适量W溶于水,有气泡产生,说明固体中含有氮元素,该结论不正确.若要得出正确结论,还需进行的实验是将湿润的红色石蕊试纸置于容器口,试纸变蓝色,说明固体中含有氮元素.
(3)测定W中CaCN2的质量分数
步骤Ⅰ:按图2所示装置(夹持仪器已略去)进行实验:关闭弹簧夹,将漏斗中溶液逐滴加入到三颈瓶中,当W反应完全后,打开弹簧夹,通入氮气,直至氨气被200mL0.1mol•L-1硫酸完全吸收.
步骤Ⅱ:准确量取烧杯中溶液20.00mL置于锥形瓶中,滴入几滴指示剂,用cmol•L-1NaOH溶液滴定过量的硫酸,实验测得消耗标准溶液的平均体积为vmL.
已知三种常用指示剂变色pH范围如下:
①上述滴定过程中,不宜选用的指示剂是b(填字母序号);
②三颈瓶中除了发生生成氨气的反应,还有:CaC2+2H2O=C2H2↑+Ca(OH)2(用化学方程式表示),烧杯中最终吸收氨气的物质的量为0.04-0.01cvmol;经进一步计算可求得W中CaCN2质量分数.
③上述实验所得结果明显偏小,若不考虑装置的气密性和操作误差,则导致结果偏小的可能原因是步骤Ⅰ中未加热反应容器或生成碳酸钙覆盖在固体表面,导致反应不完全(写1种).
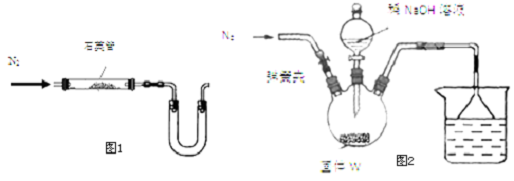
(1)某同学采用图1装置(加热和夹持仪器已略去)制取少量的CaCN2
①U形管中盛放的物质是碱石灰或无水氯化钙等(填一种),其作用是:防止空气中的水进入石英管影响实验
②不能(填“能”或“不能”)用普通玻璃管代替图中石英管;
(2)检验反应后的固体(用W表示)中含有氮元素该同学将适量W溶于水,有气泡产生,说明固体中含有氮元素,该结论不正确.若要得出正确结论,还需进行的实验是将湿润的红色石蕊试纸置于容器口,试纸变蓝色,说明固体中含有氮元素.
(3)测定W中CaCN2的质量分数
步骤Ⅰ:按图2所示装置(夹持仪器已略去)进行实验:关闭弹簧夹,将漏斗中溶液逐滴加入到三颈瓶中,当W反应完全后,打开弹簧夹,通入氮气,直至氨气被200mL0.1mol•L-1硫酸完全吸收.
步骤Ⅱ:准确量取烧杯中溶液20.00mL置于锥形瓶中,滴入几滴指示剂,用cmol•L-1NaOH溶液滴定过量的硫酸,实验测得消耗标准溶液的平均体积为vmL.
已知三种常用指示剂变色pH范围如下:
| 指示剂 | a | b | c |
| 变色pH范围 | 3.1~4.4 | 8.0~10.0 | 4.4~6.2 |
| 说明 | pH<3.1显红色 pH>4.4显黄色 | pH<8.0显无色 pH>10.0显红色 | pH<4.4显红色 pH>6.2显黄色 |
②三颈瓶中除了发生生成氨气的反应,还有:CaC2+2H2O=C2H2↑+Ca(OH)2(用化学方程式表示),烧杯中最终吸收氨气的物质的量为0.04-0.01cvmol;经进一步计算可求得W中CaCN2质量分数.
③上述实验所得结果明显偏小,若不考虑装置的气密性和操作误差,则导致结果偏小的可能原因是步骤Ⅰ中未加热反应容器或生成碳酸钙覆盖在固体表面,导致反应不完全(写1种).
