题目内容
16.下列说法正确的是( )| A. | 在101kPa下,1g物质完全燃烧所放出的热量叫该物质的热值,单位为kJ•mol-1 | |
| B. | 某放热反应在其它条件不变时,加入催化剂后反应速率加快,同时会放出更多的热量 | |
| C. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H1;C5H12(g)+8O2(g)═5CO2(g)+6H2O(l)△H2.反应热△H1>△H2 | |
| D. | 500℃、30MPa 下,将 0.5mol N2(g)和 1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热 19.3 kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 |
分析 A、注意单位;
B、催化剂只能加快反应速率,不影响反应程度;
C、根据气态水转变成液态水还要放热判断;
D、0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,据此分析.
解答 解:A、热值的单位是KJ/g,故A错误;
B、不影响平衡移动,对反应热大小无影响,故B错误;
C、气态水转变成液态水还要放热,所以C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H1;C5H12(g)+8O2(g)═5CO2(g)+6H2O(l)△H2.反应热△H1>△H2,故C正确;
D、相同条件下的同一可逆反应,正逆反应反应热数值相等,符合相反,0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,所以生成2mol氨气,放出的热量大于38.6kJ,故D错误;
故选C.
点评 本题考查了热值的概念、催化剂对反应热的影响、盖斯定律、可逆反应的反应热,题目难度不大.

练习册系列答案
相关题目
4.卤代烃能发生下列反应:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr.下列有机物中,可合成环烷烃的是( )
| A. | CH3CH2CH2Br | B. | CH3CH2CHBr2 | C. | CH2BrCH2CH2Br | D. | CH3CHBrCH2CH2Br |
11.一定量的CuS投入足量的HNO3中,收集到标准状况下的气体VL,向反应后的溶液中加入足量的NaOH,产生蓝色沉淀,经过滤、洗涤、灼烧,得到CuO12g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V为( )
| A. | 9.0L | B. | 13.44L | C. | 15.7L | D. | 16.8L |
1.如图所示能够组成原电池,并且产生明显的电流的是( )
| A. |  | B. |  | C. |  | D. |  |
8.关于如图装置的下列叙述中不正确的是( )
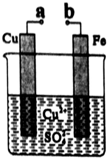

| A. | 无论a和b是否连接,该装置的反应原理相同 | |
| B. | a和b分别连接直流电源正、负极可以实现铁上镀铜 | |
| C. | a和b不连接时反应速率比a和b用导线连接时的速率慢 | |
| D. | 在a、b之间连接一小灯泡,改变Cu2+的浓度不会影响灯泡亮度 |
5.用氯气制取并获得碘单质,不能实现实验目的装置是( )
| A. | 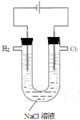 用甲制取少量氯气 | B. | 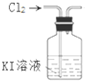 用乙氧化溶液中的碘离子 | ||
| C. | 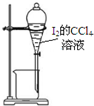 用丙提取置换出来的碘 | D. |  用丁过滤I2的CCl4溶液得碘单质 |
6.下列装置中能将电能转化为化学能的是( )
| A. |  | B. |  | C. |  | D. |  |
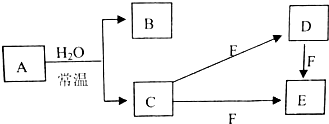
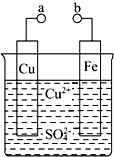 某小组为研究电化学原理,设计如图装置.请回答下列问题:
某小组为研究电化学原理,设计如图装置.请回答下列问题: