题目内容
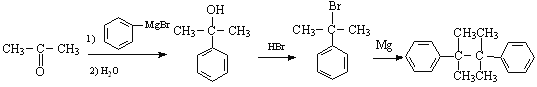
【题目】由化合物A 合成黄樟油(E)和香料F的路线如下(部分反应条件已略去):

请回答下列问题:
(l)下列有关说法正确的是______(填选项字母)。
a.化合物A 核磁共振氢谱为两组峰
b.CH2Br2只有一种结构
c.化合物E能发生加聚反应得到线型高分子
d.化合物B能发生银镜反应,也能与NaOH溶液反应
(2)由B转化为D所需的试剂为________。
(3)D含有的官能团名称为_______,C的同分异构体中具有顺反异构的是______(填名称,不必注明“顺”“反”)。
(4)写出A→B的化学反应方程式:_________。
(5)满足下列条件的E的同分异构体W有______种(不含立体异构),其中核磁共振氢谱为五组峰且峰面积之比是1:2:2:2:3的结构简式为________。
① lmolW与足量NaOH溶液反应,能消耗2molNaOH
② 能发生银镜反应
③ 苯环上只有两个取代苯,能发生聚合反应
(6)参照上述合成路线,写出以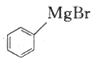 、
、 为主要原料(无机试剂任选),设计制备
为主要原料(无机试剂任选),设计制备 的合成路线:________________________。
的合成路线:________________________。
【答案】 bc 液溴、Fe(或液溴、FeBr3) 醚键、溴原子 1-溴丙烯  9
9 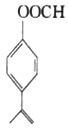
【解析】根据A的分子式和性质,判断为酚,再根据D的结构,可以判断A为邻二苯酚(![]() ),B为
),B为![]() 。
。
(l)a.A为邻二苯酚(![]() ),核磁共振氢谱为三组峰,故a错误;b. 甲烷是正四面体结构,因此CH2Br2只有一种结构,故b正确;c.化合物E为
),核磁共振氢谱为三组峰,故a错误;b. 甲烷是正四面体结构,因此CH2Br2只有一种结构,故b正确;c.化合物E为![]() ,含有碳碳双键,能发生加聚反应得到线型高分子,故c正确;d.B为
,含有碳碳双键,能发生加聚反应得到线型高分子,故c正确;d.B为![]() ,不存在醛基,不能发生银镜反应,故d错误;故选bc;
,不存在醛基,不能发生银镜反应,故d错误;故选bc;
(2)由B转化为D是在苯环上引入溴原子,需要试剂为液溴、Fe,故答案为:液溴、Fe;
(3)根据D的结构可知,其含有的含氧官能团为醚键和溴原子,C的同分异构体中具有顺反异构的是1-溴丙烯,故答案为:醚键、溴原子;1-溴丙烯;
(4)A为邻二苯酚(![]() ),B为
),B为![]() ,A→B的化学方程式为:
,A→B的化学方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(5)E为![]() ,E的同分异构体W满足:① lmolW与足量NaOH溶液反应,能消耗2molNaOH ;② 能发生银镜反应;③ 苯环上只有两个取代苯,能发生聚合反应,说明苯环上含有2个侧链,其中含有碳碳双键、醛基或属于甲酸某酯,结合E的结构,W属于甲酸苯酚酯,即HCOO-
,E的同分异构体W满足:① lmolW与足量NaOH溶液反应,能消耗2molNaOH ;② 能发生银镜反应;③ 苯环上只有两个取代苯,能发生聚合反应,说明苯环上含有2个侧链,其中含有碳碳双键、醛基或属于甲酸某酯,结合E的结构,W属于甲酸苯酚酯,即HCOO-![]() ,另一个侧链为-CH2CH=CH2或-CH=CH2CH3或-C(CH3)=CH2,每种侧链对应与邻位、间位、对位3种结构,共9种,其中核磁共振氢谱为五组峰且峰面积之比是1:2:2:2:3的结构简式为
,另一个侧链为-CH2CH=CH2或-CH=CH2CH3或-C(CH3)=CH2,每种侧链对应与邻位、间位、对位3种结构,共9种,其中核磁共振氢谱为五组峰且峰面积之比是1:2:2:2:3的结构简式为![]() ,故答案为:9;
,故答案为:9;![]() ;
;
(6)以![]() 、
、![]() 为主要原料制备
为主要原料制备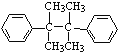 ,可以将丙酮,与
,可以将丙酮,与![]()
 ,故答案为:
,故答案为: 。
。

【题目】某研究性学习小组的同学设计了如图装置制取溴苯和溴乙烷:

已知:乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
溶解性(本身均可作溶剂) | 沸点(℃) | 密度(g/mL) | |
乙醇 | 与水互溶,易溶于有机溶剂 | 78.5 | 0.8 |
溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
请回答下列问题:
(1)B中发生反应生成目标产物的化学方程式为___________。
(2)根据实验目的,选择合适的实验步骤:①→____________。
①组装好装置,_________________(填写实验操作名称);
②将A装置中的纯铁丝小心向下插入苯和液溴的混合液中;
③点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10分钟;
④向烧瓶中加入一定量苯和液溴,向锥形瓶中加入无水乙醇至稍高于进气导管口处,向U形管中加入蒸馏水封住管底,向水槽中加人冰水。
(3)简述实验中用纯铁丝代替铁粉的优点:_________________。
(4)反应完毕后,U形管内的现象是_________;分离溴乙烷时所需的玻璃仪器是___________。
(5)假设最初取用的无水乙醇是71.9 mL,最后得到的纯净的溴乙烷是66.2 mL,则溴乙烷的产率为______________(保留两位小数)。
【题目】氮和硫的化合物在科研、生活及化学工业中具有重要的应用。
(1)已知:SO2(g)+1/2O2(g)=SO3(g) H=-99kJ·mol-1
SO2(g)+NO2(g)=SO3(g)+ NO(g) H=-41.8kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) H=-283kJ·mol-1
请写出CO和NO2反应生成CO2和NO的热化学反应方程式_________________,1molCO和1molNO2反应生成CO2和NO的能量反应示意图中的E2=_______kJ·mol-1

(2)可通过反应2CO(g)+SO2(g)![]() 2CO2(g)+S(l)来消除锅炉烟道气中的有毒气体,某温度下向密闭容器中通入一定量的SO2和CO气体发生反应,5分钟后达平衡,生成0.5 mol/L的CO2。
2CO2(g)+S(l)来消除锅炉烟道气中的有毒气体,某温度下向密闭容器中通入一定量的SO2和CO气体发生反应,5分钟后达平衡,生成0.5 mol/L的CO2。
①反应开始至平衡时,SO2的平均反应速率v(SO2)=________;
②其他条件不变时,SO2的平衡转化率随反应温度变化如图,请用简洁文字解释原因_________________________________________;

(3)25℃,在0.10 molL1H2S溶液中,溶液pH与c(S2)关系如下表(忽略溶液体积的变化、H2S的挥发),某溶液含0.020 molL1Mn2+、0.1 molL1H2S,当溶液的pH=5时,
Mn2+开始沉淀,则MnS的溶度积Ksp =________________;
pH | 3 | 5 | 7 | 9 | 11 |
c(S2-)/ molL1 | 1.4×1015 | 1.4×1011 | 6.8×108 | 1.3×105 | 1.3×103 |
(4)一种脱除废水中NH4+ 的电化学装置如图所示,请写出阳极的电极反应方程式:____________, 电解一段时间后阴极周围溶液的pH_____(填“增大”, “减小”或“不变”)。


