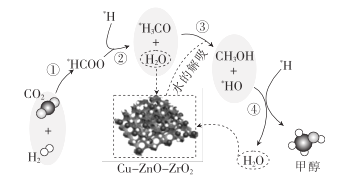
题目内容
【题目】![]() 某有机物
某有机物![]() 与足量的氧气充分反应后,将所得气体产物依次通过盛有浓硫酸和碱石灰的装置,两装置分别增重
与足量的氧气充分反应后,将所得气体产物依次通过盛有浓硫酸和碱石灰的装置,两装置分别增重![]() 、
、![]() ;同温同压下,
;同温同压下,![]() 蒸气的密度是
蒸气的密度是![]() 的37倍。则能够与钠反应放出
的37倍。则能够与钠反应放出![]() 的
的![]() 的结构有(不考虑立体异构)( )
的结构有(不考虑立体异构)( )
A.6种B.5种C.4种D.3种
【答案】C
【解析】
有机物燃烧生成二氧化碳和水,依次被浓硫酸吸收水、碱石灰吸收二氧化碳。根据阿伏加德罗定律,同温同压下的气体,气体体积和物质的量成正比,据此回答问题。
产物通过浓硫酸增重9g,吸收9g水,n(H原子)=![]() ;通过碱石灰增重17.6g,吸收17.6g二氧化碳,n(C原子)=
;通过碱石灰增重17.6g,吸收17.6g二氧化碳,n(C原子)=![]() ,即n(H原子):n(C原子)=1:0.4=5:2。
,即n(H原子):n(C原子)=1:0.4=5:2。
根据PV=nRT(R为常数)可知,![]() ,即同温同压下,气体密度与气体摩尔质量成正比,
,即同温同压下,气体密度与气体摩尔质量成正比,![]() 蒸气的密度是
蒸气的密度是![]() 的37倍,即A的摩尔质量为74g/mol。综上所述,n(有机物):n(H原子):n(C原子)=0.1:1:0.4=1:10:4;根据摩尔质量可知,分子中含有1个氧原子,有机物分子式为C4H10O,即若能够与钠反应放出
的37倍,即A的摩尔质量为74g/mol。综上所述,n(有机物):n(H原子):n(C原子)=0.1:1:0.4=1:10:4;根据摩尔质量可知,分子中含有1个氧原子,有机物分子式为C4H10O,即若能够与钠反应放出![]() 的结构含有羟基,属于饱和一元醇,丁烷有正丁烷和异丁烷两种结构,因此,正丁烷中有2种不同环境的氢,其被1个羟基取代的产物有2种,异丁烷中有2种不同环境的氢,其被1个羟基取代的产物有2种,共有4种。
的结构含有羟基,属于饱和一元醇,丁烷有正丁烷和异丁烷两种结构,因此,正丁烷中有2种不同环境的氢,其被1个羟基取代的产物有2种,异丁烷中有2种不同环境的氢,其被1个羟基取代的产物有2种,共有4种。
答案为C。

【题目】如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.
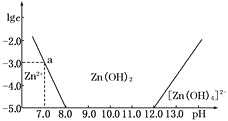
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是__________________。
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
c(HCl) | |||||||
(mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
103c(PbCl2) | |||||||
(mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 14.01 |
根据上表数据判断下列说法正确的是________。
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大 |
B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度 |
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子) |
D.PbCl2固体可溶于饱和食盐水 |
【题目】有五种短周期元素,它们的结构、性质等信息如下表所示:
元素 | 结构、性质等信息 |
A | 是短周期元素(稀有气体元素除外)中原子半径最大的元素,含该元素的某种合金是原子反应堆的导热剂 |
B | 与A同周期,其最高价氧化物对应的水化物呈两性 |
C | 其气态氢化物极易溶于水,液态时常用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的杀菌消毒剂 |
E | 元素原子的 |
请根据表中信息回答下列问题。
(1)![]() 元素原子的核外电子排布式为______。
元素原子的核外电子排布式为______。
(2)![]() 元素在元素周期表中的位置为______;离子半径:
元素在元素周期表中的位置为______;离子半径:![]() ______(填“
______(填“![]() ”或“
”或“![]() ”)
”)![]() 。
。
(3)![]() 元素原子的电子排布图为其原子核外有______个未成对电子,能量最高的电子排布在______轨道上,该轨道呈______。
元素原子的电子排布图为其原子核外有______个未成对电子,能量最高的电子排布在______轨道上,该轨道呈______。
(4)![]() 元素原子的核外电子排布式为______,
元素原子的核外电子排布式为______,![]() 的结构示意图为______。
的结构示意图为______。
(5)![]() 、
、![]() 元素的第一电离能的大小关系是______(用元素符号表示)。
元素的第一电离能的大小关系是______(用元素符号表示)。
(6)已知![]() 分子中
分子中![]() 元素显
元素显![]() 价,则该情况下,
价,则该情况下,![]() 、
、![]() 元素的电负性大小关系是______(用元素符号表示),
元素的电负性大小关系是______(用元素符号表示),![]() 与水反应后的产物是______(填化学式)。
与水反应后的产物是______(填化学式)。