题目内容
【题目】天然水因含有Ca2+、Mg2+、HCO3—等离子,煮沸后会形成水垢。现有一种干燥水垢6.32g ,加热除去全部结晶水,得到固体M 5.78 g;高温灼烧M至恒重,残余固体为CaO和MgO;放出的气体通入足量澄清石灰水中,产生沉淀6.00g;若产生的气体完全被碱石灰吸收,碱石灰增重2.82g。下列推断合理的是( )
A.M 中一定不含Mg(OH)2B.M中一定含有MgCO3
C.5.78 g M中含CaCO30.05molD.水垢中碳酸盐质量分数为0.823
【答案】BD
【解析】
放出的气体通入足量澄清石灰水中,产生沉淀6.00g,可知n(CO2)=n(CaCO3)=![]() 0.06mol,5.78g剩余固体A灼烧生成二氧化碳的质量为0.06mol×44g/mol=2.64g,碱石灰增重2.82g,故生成水的质量为2.82g-2.64g=0.18g。
0.06mol,5.78g剩余固体A灼烧生成二氧化碳的质量为0.06mol×44g/mol=2.64g,碱石灰增重2.82g,故生成水的质量为2.82g-2.64g=0.18g。
A. n(CO2)=0.06mol,假设二氧化碳全部来自碳酸钙,则m(CaCO3)=0.06mol×100g/mol=6g,6.00g>5.78g,A中一定有MgCO3,A错误;
B.由以上分析可知一定含有MgCO3,B正确;
C.固体A中含有氢氧化镁,由H元素守恒可知,n[Mg(OH)2]=n(H2O)=0.01mol,故m[Mg (OH) 2]=0.01mol×58g/mol=0.58g,n(CaCO3)+n(MgCO3)=0.06mol,n(CaCO3)×100g/mol+n(MgCO3)×84g/mol+0.58g=5.78g,解得:n(MgCO3)=0.05mol,n(CaCO3)=0.01mol,C错误;
D.水垢中碳酸盐质量分数为![]() =0.823,D正确。
=0.823,D正确。
答案为BD。

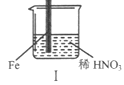
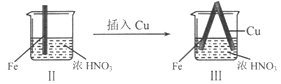
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
【题目】(1)某元素原子共有3个价电子,其中一个价电子位于第三能层![]() 能级,该能层有______个原子轨道,该元素基态原子的价电子排布图为______。
能级,该能层有______个原子轨道,该元素基态原子的价电子排布图为______。
(2)![]() 、
、![]() 均为短周期金属元素。依据下表数据,写出
均为短周期金属元素。依据下表数据,写出![]() 原子的核外电子排布式:______。
原子的核外电子排布式:______。
电离能/ |
|
|
|
|
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |